FDA 510(k)认证流程:电动轮椅和手动轮椅关键差异
FDA 认证要求对轮椅的材料安全性、机械性能、电气性能(电动轮椅)等进行严格测试。如通过稳定性、强度测试,确保轮椅在正常使用和预期极端情况下不会倾倒或损坏,避免使用者受伤;对于电动轮椅,电气安全测试可防止触电、电池过热等危险情况发生。

一、电动轮椅510(k)核心差异总览
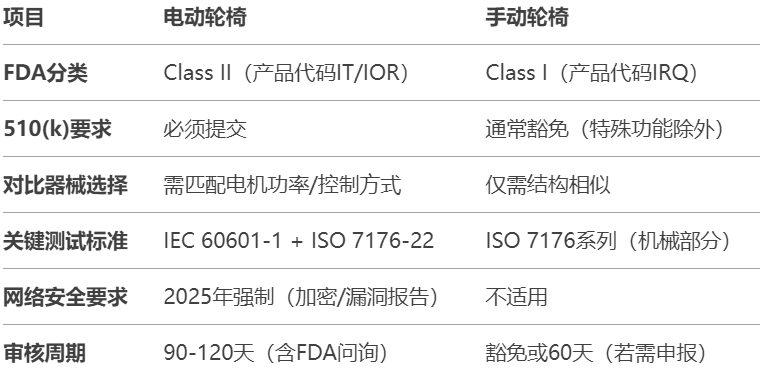
二、电动轮椅510(k)特殊要求
1. 额外测试项目
电气安全:
绝缘耐压测试(1500V AC/1分钟)
电池过充/短路保护(UN38.3认证)
功能安全:
防失控设计(如电磁刹车失效测试)
坡度驻车能力(≥10°斜坡保持30分钟)
2. 技术文档重点
电机性能曲线图(扭矩/转速关系)
控制系统FMEA(故障模式分析)
网络安全文件(含蓝牙/Wi-Fi模块需提供)
3. 标签要求
警示语:"Warning: Risk of fire or electric shock - Do not expose to rain"
电池更换说明(必须使用原厂指定型号)
三、手动轮椅510(k)豁免条件
1. 可豁免的常规型号
固定框架无调节功能
标准座椅(无压力缓解设计)
普通轮毂(非快拆式)
2. 需申报的特殊情况
可站立式(需提交机械强度测试)
智能刹车系统(需对比已上市的智能轮椅)
新材料应用(如碳纤维需生物相容性报告)
3. 简化测试方案
仅需提供:
静态负载测试(≥100kg)
疲劳测试(20万次循环)
材料化学成分声明(RoHS合规)

四、2025年共同新规
1. eSTAR强制电子提交(所有510(k)申请)
2. 真实世界数据(RWD)接受度提高:
可提交医院试用报告替代部分实验室测试
3. UDI标识要求:
电动轮椅需在主机和电池分别标注UDI-DI
五、操作建议
1. 电动轮椅优先步骤:
提前6个月进行电池安全认证(UL 2271)
预留3个月处理FDA问询(常见于网络安全问题)
2. 手动轮椅合规策略:
通过FDA的Class I豁免清单确认资格(数据库编号890.3940)
若含特殊功能,选择Abbreviated 510(k)路径
3. 共同注意事项:
所有测试需在FDA认可实验室完成(ISO 17025资质)
说明书必须包含FDA规定的禁用人群声明
六、常见问题
Q1:电动轮椅电机升级需要重新510(k)吗?
A:功率变化≥20%或控制逻辑修改需提交新申请。
Q2:手动轮椅出口美国是否只需符合ISO 7176?
A:否,FDA要求额外满足21 CFR 890部分(如标签格式)。
Q3:FDA是否会抽查豁免产品?
A:是的,Class I产品仍需符合GMP要求(21 CFR 820)。









