FDA认证将I类设备UDI截止日期推迟到2022年9月
FDA将I类设备的UDI
2020年6月30日,FDA认证颁布了有关其政策的即时生效指南,该政策涉及I类和不可植入,无法维持生命或无法维持生命的未分类设备的合规日期。该指南解释说,目前,FDA并不打算强制执行UDI标签(21 CFR 801.20&801.50),直接标记(21 CFR 801.45),GUDID数据提交(21 CFR 830.300)和标准日期格式(21 CFR)。 801.18)要求在2022年9月24日之前。
FDA建立了独特的设备识别系统,以充分识别从制造到分销再到患者使用在美国销售的医疗设备。
全面实施后,大多数设备的标签都将包含人类和机器可读形式的唯一设备标识符(UDI),这将最终提高患者安全性,使设备售后监视现代化并促进医疗设备创新。
该决定部分是由于冠状病毒的持续流行所致。FDA在其指南中表示:“准备实施UDI要求,同时应对与2019年冠状病毒病相关的挑战可能非常困难,并且可能会将资源从COVID-19应对工作中转移出来。” “在一定程度上,该政策可以帮助贴标商继续关注与COVID-19相关的公共卫生需求,我们认为该政策与公共卫生更加一致。”
尽管存在延迟,但还是要谨慎准备,尽早开始,因为许多UDI标签制造商都面临实施方面的挑战。为了帮助行业做好准备,我们汇总了自2014年发布UDI规则以来发布的资源。
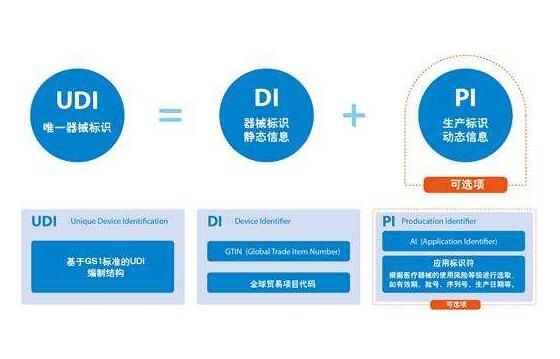
什么是UDI?
UDI是数字或字母数字代码,由两部分组成:设备标识符(DI)和生产标识符(PI)。对于所有UDI,DI是固定的和强制性的。它标识标签和设备的特定版本或型号。PI是UDI的有条件的可变部分,用于标识标签中包含的以下一项或多项内容:
批号或批号
序列号
到期日
制造日期
被调节为设备的人体细胞,组织或基于细胞和组织的产品(HCT / P)的独特识别码
相关产品FDA认证可咨询商通检测快速办理!










