电动轮椅出口美国FDA(510K)认证指南
美国食品药品监督管理局(FDA)对医疗器械的管理极为严格,所有医疗器械进入美国市场前都必须进行企业注册(Registration)和产品列名(Listing)。对于高风险产品,如电动轮椅,还需申请FDA 510K认证。
FDA将医疗器械分为1700个类别,电动轮椅属于ITI类别,需按照FDA 510K要求进行注册。510K认证的核心在于证明申请产品与市场上已合法销售的同类产品(即“谓词设备”)具有实质等同性(Substantial Equivalence)。

一、电动轮椅FDA 510(k) 认证基础
1. 适用产品范围
电动轮椅(Power Wheelchairs)被FDA归类为 Class II 医疗设备(产品代码:ITI)。
其他相关产品:电动代步车(Scooters, 代码:KLS)需单独申请。
2. 认证路径
510(k) 预市通知(Premarket Notification):需证明产品与已合法上市的 predicate device(对比设备)实质等效(Substantially Equivalent, SE)。
豁免情况:部分手动轮椅(Class I)无需510(k),但电动轮椅必须申请。
二、电动轮椅FDA 510(k) 认证核心流程
步骤1:确定产品分类与对比设备
FDA数据库查询:
通过 FDA确认产品代码(如ITI)及对比设备(如Sunrise Medical的Quickie Q500)。
选择对比设备:
需与您的产品在 用途、技术特性、安全性 上高度相似。
步骤2:准备技术文件
必需文件清单:
510(k)申请表:FDA Form 3514,包含企业信息、产品描述、对比分析。
设备描述:技术规格(尺寸、重量、电池类型、最大速度等)、工作原理图、软件说明(如适用)。
性能测试报告:安全性、耐久性、电磁兼容性(EMC)测试(详见第四部分)。
生物相容性报告:仅接触皮肤部件需符合ISO 10993(如座椅材料)。
标签与说明书:英文版,含安全警告、禁忌症、维护指南(21 CFR 801)。
实质等效声明:对比分析表(证明与predicate device的差异不影响安全性)。
步骤3:测试要求
关键测试项目:
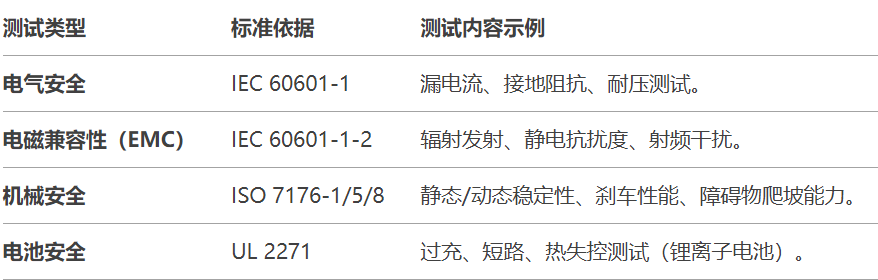
步骤4:提交510(k)申请
提交方式:通过FDA在线提交。
步骤5:FDA审核与SE决定
审核通过后产品可合法上市,需在FDA完成企业及产品注册。

四、常见问题解答
Q1:是否需要美国本地代理?
必须 指定一名 美国代理人(U.S. Agent),负责与FDA沟通(21 CFR 807.40)。
Q2:510(k)豁免情况?
电动轮椅 无豁免,必须申请510(k)。仅部分Class I手动轮椅或配件可能豁免。
Q3:测试能否在中国实验室完成?
可以,但实验室需具备 ISO 17025 资质,且测试报告需英文并符合FDA认可标准(如IEC 60601)。
Q4:FDA是否会现场验厂?
通常不验厂,但可能抽查质量体系(需符合21 CFR 820,即QSR)。
五、关键注意事项
1. 精准选择对比设备:避免因差异过大导致拒批(如对比设备为室内型,而您的产品为户外全地形)。
2. 标签合规性:
必须标注 “Caution: Federal law restricts this device to sale by or on the order of a licensed practitioner.”
3. 年度维护:
每年更新企业注册(FDA Unified Registration)和产品列名。










