3分钟看懂-美国药物主文件DMF申报流程和管理制度
药品的出口至美国市场需要遵循严格的法规和管控政策,OTC、处方药、原料药以及包装材料的进口管理。美国食品药品监督管理局(FDA)是主要的监管机构,其对药品的进口有明确的要求和程序。
OTC、处方药一般做FDA NDC注册以及ANDA注册,原料药、辅料、包材一般做DMF药物主文件。

什么是DMF药物主文件?
美国药物主文件(Drug Master File,简称DMF)是由药物制造商、药物成分供应商或包装材料供应商等提交给美国食品药品监督管理局(FDA)的机密文件。DMF注册通常包含有关药物的化学、制造和控制信息,以及其他与药物质量和安全性相关的数据。
DMF的目的是向FDA提供关于药物成分、制造过程、质量控制和标准等方面的详细信息,以支持申请者在提交新药申请(NDA)、生物制品许可申请(BLA)或通用药物申请(ANDA)时的文件。DMF允许制造商在保持其商业机密性的同时,与FDA分享关键的信息。
DMF也可以报告一些其他类型的信息(如:毒理信息,REMS共享系统)。
美国药物主文件DMF注册类别:
II型DMF:
II型DMF包含有关单一原料药、原料药中间体、用于制备药物的材料和药品的信息。
III型DMF:
III型DMF包含有关包装材料的信息,每种材料都必须根据其用途和成分进行描述。
IV型DMF:
IV型DMF对应于准备材料,例如赋形剂、着色剂、香料和香精。这些添加剂必须根据其制造方法、规格和测试方法进行描述。
V型DMF:
V型DMF包含FDA接受的参考信息,仅当所有其他类型都不相关时才使用这种类型的DMF,因为FDA强烈反对将V型DMF用于一般或重复信息。
DMF持有人可以授权一个或者多个申请人索引同一个DMF,无需向申请人披露DMF中的机密信息;DMF的递交完全由持有人自行决定,法规不强制要求申报DMF。
美国药物主文件DMF注册流程:
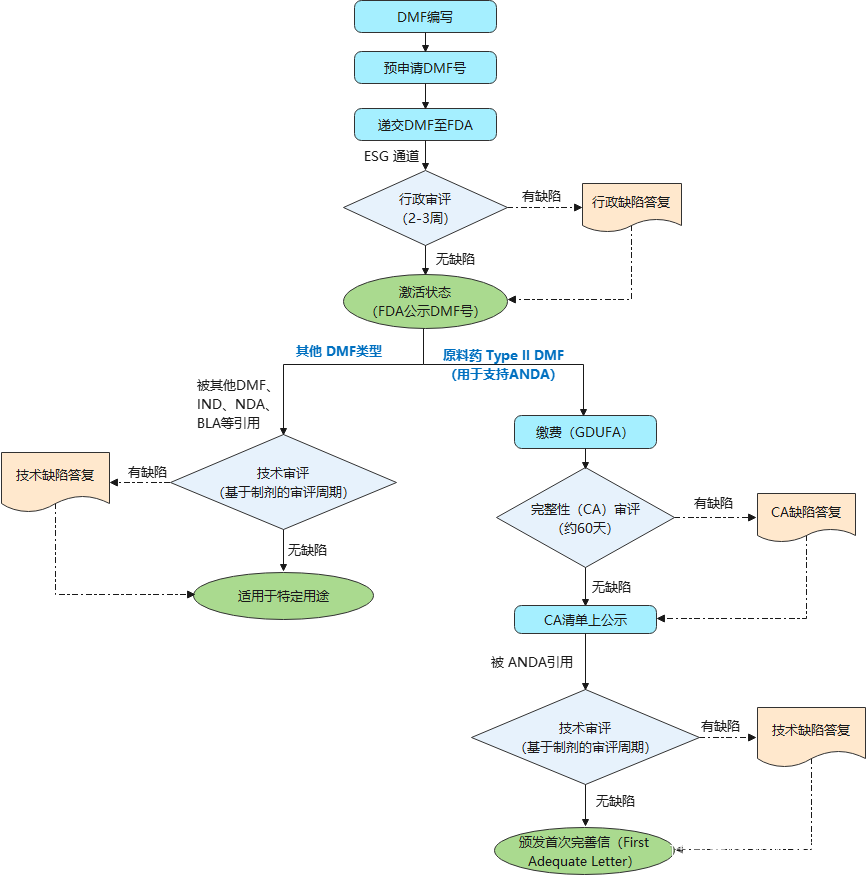
从上图看出,只有II类原料药才会交费给FDA、涉及完整性审评,其他类型DMF注册FDA没有官费。
DMF申报流程解析:
A、资料格式
1.应按ICH M4的CTD格式整理申报资料,并以eCTD格式递交(TypeI除外)
2.DMF的CTD各模块的主要内容见下表1:
3.DMF申报资料应为英文版本,任何非英文的部分均应进行翻译。
B、资料递交
1.DMF递交时必须有DMF号(预分配号):
2.如果资料小于10G,必须通过ESG通道递交;如果资料超过10G,可以通过ESG通道或者物理媒介(如:CD-ROM)递交:
3.在通过ESG提交时,从选项菜单中选择适当的中心(CDER或CBER)非常重要。若DMF持有人希望提交的资料在多个中心进行审评,则应咨询相应的各中心。
C、FDA审评
1.行政审评:一般递交后2-3周内完成:
2.完整性(CA)审评:对于原料药TypeIDMF需按GDUFA进行缴费;缴费后方能进行CA审评,一般需要60天左右;
3.技术审评:按DMF被IND、NDA、ANDA、BLA等关联引用时,才会进行技术审评
D、FDA审评结果
1.DMF不存在批准或者不批准的说法;
2.对于原料药TypeI DMF,通过技术审评后,FDA会颁发First Adequate Letter或No Further Comment Letter。
DMF申报资料内容简介:
模块1
Cover letter;
-行政信息(包括:DMF持有人、联系人/US代理人(若有)、生产商、Debarment声明)
-参考信息(授权信(LOA),授权人清单等)其他信函(环境评估等。)
模块2
总结模块3的内容(FDA强烈建议参考QbR指南)
模块3
参考指南lCH guidance forindustry M4Q: The CTD-Quality
模块4
适用于包含非临床评估的DMF:
用于支持Type IV DMF 模块3CMC中辅料安全性的非临床评估;
用于支持TypeI DMF 模块3CMC中杂质安全性的非临床评估。
模块5
临床信息,如:Type IV DMF中的临床信息。
DMF增补:
DMF增补资料政策是指在DMF已经提交给FDA后,申请者需要向DMF中增加、修改或更新内容时所涉及的政策和规定。根据FDA的要求,当DMF的内容发生变化或需要更新时,申请者应及时向FDA提交增补资料。增补资料通常需要提供详细的变更说明、实验数据、验证报告等相关文件。
DMF增补包括行政增补及质量增补;
DMF的任何变更以及信息的增加或者删减,包括LOA,都必须以DMF增补递交给FDA;
DMF增补应包含cover letter, 相关升版的行政和技术信息(若适用);
DMF持有人必须将DMF的任何变更、信息的增加和删减通知受影响的授权人(一般为制剂方),并应提供足够的信息以便授权人能够为其申请确定适当的变更报告程序。此通知应在进行任何变更之前进行,以允许授权人在适当的时间范围内报告变更。
药物主文件DMF年报更新:
药物主文件注册好之后一年需要向FDA年报,DMF年度报告的内容:
1.年度报告应包含正式的申请,说明提交的内容包含年度报告,并提及 DMF 编号。
2. 自上次年度报告以来的修订表格摘要。- 我们建议提供表格摘要,其中包含修订日期和有关修订目的的简要信息。但是,如果自上次年报以来未提出任何修改,则可以在年报中增加“自上次年报以来未提出修改”的说明。
3. 迄今为止签发 LOA(授权书)的各方名单。如果未向任何公司颁发授权,则应添加此类声明。如果必须添加所有授权方,则在每个 DMF 年度报告完整列表中。
4、被撤销授权书的当事人名单(如适用)
注:
DMF年报不能用于报告DMF中的任何变更(任何变更均需以Amendment递交);
一般情况下,自DMF递交之日开始,每年需向FDA递交年报;
若DMF未递交年度报告,FDA会通知持有人或者代理进行DMF更新。如果持有人或者代理未按要求及时递交年报,FDA将关闭此DMF,并通知持有人或者代理。
药物主文件DMF关闭:
FDA关闭:
若DMF未递交年报,FDA将关闭此DMF,并通知持有人或者代理。
DMF持有人主动关闭:
可以递交一个行政增补要求关闭DMF,同时递交一个已通知所有授权人DMF关闭的声明。
商通检测为:原料药、化学药品、生物制品提供专业GMP合规咨询服务和相关注册办理,助力各类医药企业建立或完善符合中国、美国、欧盟、日本等药品质量体系。
从现场考查、现状评估环节结合企业实际确定项目方案,以注册资料、GMP法规及指南为标准,指导和带领企业进行生产现场GMP“软”“硬”件的整改与完善,帮助企业全面做好“GMP符合性检查”前的各项准备工作,通过GMP现场检查。










