欧盟原料药ASMF注册流程和文件资料介绍
原料药ASMF注册是什么?
ASMF(Active Substance Master File)是指活性原料药的注册文件,它包含了原料药的详细信息和质量控制标准,供制药厂使用。ASMF注册是制药企业将其产品的原料药注册给欧洲药品管理局(EMA)的过程。
在ASMF注册过程中,原料药生产企业需要提交一份全面的文件,包括制备方法、质量控制、稳定性数据等信息。这些文件通常是机密的,只有EMA可以查看,而EMA会对ASMF进行评估并在同意后授予原料药的注册。 ASMF的注册使得原料药的制造商能够将其产品销售到欧洲市场。
欧盟ASMF适用于以下三类原料药的申请:
1.新的活性物质,
2.已存在的活性物质,但还未被欧洲药典或欧盟成员国的药典收录;
3.已被欧洲药典或欧盟成员国的药典收录的药物活性物质。

原料药ASMF注册的注册流程:
1. 准备注册申请文件:
原料药生产企业需要准备全面的注册申请文件,包括原料药的制备方法、质量控制标准、稳定性数据等信息。这些文件通常是机密的,只有欧洲药品管理局(EMA)可以查看。
2. 提交注册申请:
制药企业将准备好的ASMF文件提交给EMA进行注册申请,同时需要支付相应的注册费用。在提交申请时,通常还需要填写详细的申请表格并提供其他必要的文件和证明材料。
3. 评估过程:
EMA会对提交的ASMF文件进行评估,确保其符合相关的质量标准和法规要求。在评估过程中,EMA可能会要求原料药生产企业提供额外的信息或者进行进一步的测试。
4. 批准注册:
如果EMA对ASMF文件满意,并认为其符合要求,那么就会批准注册该原料药。获得注册后,原料药生产企业就可以向欧洲市场销售其产品了。
ASMF的申报必须与使用该原料药的制剂的MA申请关联进行(ASMF要求不早于MA一个月或不晚于MA递交),原料药生产商通过开具授权信(LOA)实现与制剂上市许可申请的关联审评,这就意味着ASMF的审评程序和相应的制剂上市许可申请的审评程序是一致的。
ASMF注册的流程相对复杂,通常需要原料药生产企业具有一定的技术和法规知识,以确保注册申请的成功。因此,一些企业可能会委托专业的顾问商通检测协助处理ASMF注册流程。
ASMF注册申报资料要求:
1. 概要和简介:列出原料药的基本信息,包括其命名、结构式、分子式、分子量、纯度等。
2. 制备方法:包括原料的来源、化学制备方法、反应条件、工艺参数等详细信息。
3. 质量控制: 包括原料药的质量规格、分析方法、检测结果等。这部分通常包括对于杂质和纯度的详细要求和检测。
4. 稳定性数据:包括原料药在储存条件下的稳定性试验结果,以及稳定性带来的降解产物和可能的影响等。
5. 控制策略: 说明质量控制的整体策略,包括对关键步骤的控制措施、原料药的规格和标准等。
6. 可溶性和稳定性: 包括原料药的可溶性、溶解度、溶解动力学等数据。
7. 安全数据:包括对于原料药的毒性、安全概要等相关数据。
8. 其他相关信息:这可能包括对于原料药生产过程的描述、原料药的制剂过程相关信息、以及其他有关原料药质量和安全性的信息。
注册资料的具体要求会根据不同的国家和地区的法规和要求有所不同。因此,在准备ASMF注册资料时,需要对相关的法规和要求进行仔细的调研和了解。
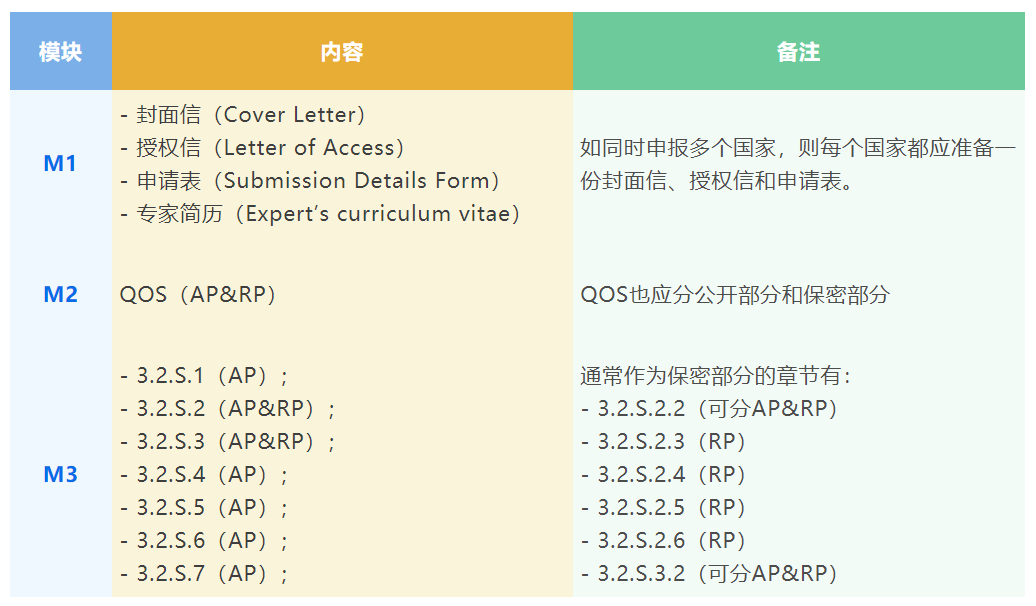
ASMF注册常见的缺陷有哪些?
1. 不完整的技术数据:
ASMF文件缺乏完整的技术数据,譬如制备方法、质量控制标准、稳定性数据等不够清晰和详尽。
2. 不规范的文件格式:
ASMF文件未按照规定的格式和标准进行准备,这可能导致欧洲药品管理局(EMA)评估过程中的延误或不顺利。
3. 缺乏充分的稳定性资料:
稳定性数据不够充分或者不符合EMA的要求,这在评估过程中可能会成为批准的障碍。
4. 质量控制不足:
质量控制参数设定不合理,分析方法不准确或不完整,或者质量控制数据不够充分。
5. 安全性和毒性数据不足:
ASMF文件未提供充分的安全性和毒性数据,无法证明原料药的安全性。
6. 不符合法规和标准:
ASMF文件中的数据不符合相关的法规和标准要求,包括欧洲药典、国际药典等。
7. 不合规的生产过程:
ASMF文件中的生产过程不符合相关的法规和质量管理要求。
制药企业在准备ASMF文件时,需要确保充分了解EMA的要求,严格按照要求准备注册文件,以避免出现以上缺陷。同时,最好寻求专业机构商通检测技术咨询支持,确保注册文件的合规性和完整性。










