美国原料药DMF申报完整性审评内容和结果
美国原料药的定义:
在美国,根据《联邦法》 21 CFR 210,“原料药”是指作为制造成品药品的一个有源成分或一个活性成分的药品的重要组成部分。 这些有源成分是制定成品药品必备的成分。同样,他们的数量或对个人的剂量可变化。 原料药包括挥发性油、一切共轭、嵌理物质、色拉、活性化合物、生物化合物,也包括拆独学剂、放射性引物,以及制药技术前期被用于制备制药产物的物质。
原料药包括活性药物的成分和制备药物的关键成分。它们也包括作为药物的入口物质。原料药与药品成品或终端制剂不同。
需要注意的是,21 CFR 210也提到了原料药的生物学制品定义,指的是包括细菌和病毒来源的药品、种子、培养基和生产介质等。
一般有以下特点:
(A)不稳定或者不能单独运输的一种物质或者混合物:
(i)是药品的组成部分;
(i)发挥药理活性作用或在诊断、治愈、缓解、治疗或预防疾病方面的其他直接作用,或影响身体结构或任何功能的物质;不包括用于合成该物质的中间体。
(B)拟进行最终的结晶、纯化,或成盐,或这些活性成分的组合,以变成(A)所述的一种物质或者混合物

什么是DMF完整性审评?
美国FDA对原料药DMF(Drug Master File)的完整性审评是指在DMF提交后的初步审查阶段,以确保DMF内部文件的完整性和合规性。这一审查程序旨在验证提交的DMF是否包含了所需要的详细信息,以便作为药品申报的支持材料。
在DMF的完整性审评中,FDA审查人员会检查提交的文档是否包含了核心参数和必要的信息,以支持包括新药申请(NDA)、生物制品许可证(BLA)或其他相关的申请。这些信息可能包括药物的化学、制备、控制过程等方面的详细数据,以及批记录、质量控制标准、稳定性数据等。此外,FDA也会审核DMF中是否包含适当的索引和概要以及其他文件,以确保相应的信息可被易于检索或审查。
若DMF在完整性审评中未能满足FDA的要求,FDA可能会提出相关问题或建议,要求申请人提供更多的信息或者进行修改。因此,确保DMF在递交前充分准备并与FDA的要求一致,对于顺利通过审查过程至关重要。
II类原料药DMF 的审评特点包括:
1. 独立性:II类DMF 是独立的,它并不直接支持提交申请,而是为FDA提供关于原料药的详细信息,并允许FDA查阅该信息。
2. 保密性:II类 DMF的内容通常被视为商业机密信息,并不会向公众公开。
3. 作为支持文件:II类DMF 文件不被FDA审阅,而是作为支持该类型证明文件的原始资料。FDA会在与提交的药物申请(IND、NDA或BLA)相关的审查过程中参考DMF中的信息。
4. 提供详尽信息:DMF需要提供关于原料药的化学、制造和质量控制等方面的详尽信息,确保原料药的质量和安全。
DMF持有人在首次授权ANDA申请索引该DMF时需支付DMF审评费,TypeⅡ 原料药DMF的技术审评必须先通过CA审评,FDA承诺90%的DMF会在60天内完成CA审评。
每年DMF II类原料药审评费都有区别,可参看FDA官网链接:
https://www.fda.gov/industry/fda-user-fee-programs/generic-drug-user-fee-amendments

原料药DMF CA审评的主要内容及结果:
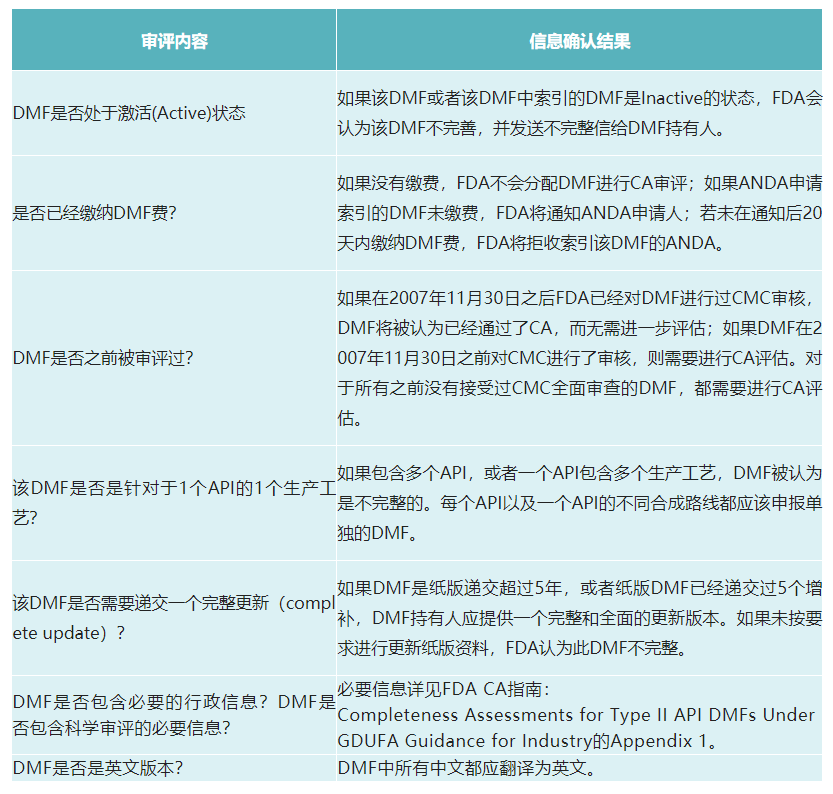
CA审评的结果:
1.如果DMF通过CA审评,其是完善的,DMF号将公布在FDA网站的CA清单上;
2.如果DMF未通过CA审评,FDA将发送GDUFADMF Incomplete Letter给DMF持有人,告知DMF缺失的信息,每一条缺陷信息对应于CA指南中对应的编号;
3.DMF持有人应递交DMF增补以纠正GDUFADMF Incomplete Letter中的缺陷,FDA将再次审评修订后的DMF。如果无缺陷,则通过CA审评,并将DMF号公布在CA清单上。
怎么顺利通过美国原料药DMF CA完整性审评?
为了快速通过美国药品管理局(FDA)对原料药的DMF(Drug Master File)完整性审查,以下是一些建议:
1. 审查指南:在提交 DMF 之前,仔细研究并确保您遵循 FDA 关于 DMF 完整性审查的相关指南。理解 FDA 对于需要提交的信息和文件的要求。
2. 完整准确的信息:确保所有提交的信息和文件都是完整并且符合 FDA 的要求。任何缺失或错误的信息会导致审查的延迟。
3. 标准文件格式:确保文件格式符合 FDA 的要求,并且文件内容的质量高,以便 FDA 审查人员可以快速且准确地找到所需的信息。
4. 提前咨询:如果可能的话,提前向 FDA 进行咨询以确认您所提交的文件和信息是否符合他们的期望。
5. 专业支持:寻求专业的法规顾问或持证机构的帮助,以确保您的 DMF 符合要求,并提供所有必要的信息。
需要注意的是,通过 FDA 的 DMF 完整性审核可能会因产品类型、复杂性和 FDA 的工作负荷等因素而有所不同。
FDA建议DMF持有人最好在ANDA递交前6个月递交DMF,并启动CA审评,以确保ANDA递交时索引的该DMF已经通过CA,并公布在FDA网站的CA清单中。DMF持有人在递交DMF前应仔细参考CA指南,确保FDA要求的各项资料都已提供,以期尽早通过CA审评。










