美国新药ANDA申请流程,递交资料须知
新药申请(Abbreviated New Drug Application)简介:
《新药申请(Abbreviated New Drug Application, ANDA)》是美国食品药品监督管理局(FDA)批准应用于已有的药物的一种专门的申请程序。ANDA用于对已经获批准的有源药物的仿制药进行申请。一般情况下,原创药物的专利期限已经届满或者已被撤销。申请人必须证明仿制药与原药相似,且具有相同的安全性和有效性,才能获得批准。

ANDA的主要组成部分有以下五个:
1. 靶向药物(Reference Listed Drug, RLD):即仿制品的“对应参考药物”,必须是已获FDA批准上市的原创药物。
2. 药物相似比较(Chemistry, Manufacturing, and Controls, CMC):包括对原创药物和仿制品药物成分的确认、合成方面的要求等。
3. 生物利用度(Bioequivalence):需证明仿制品和原创药物在人体内的生物利用度相同。
4. 标签和包装(Labeling and packaging):必须与RLD的标签和包装信息一致。
5. 申请程序(Administrative documentation):必须包括所有法定申请材料,并同时展示仿制品的安全性和有效性。
ANDA审批目的是促使仿制药在安全、有效、高质量条件下上市,为公众提供廉价的药品选择。该程序提供了机制保证了消费者获得了质量保障的仿制药。
需要注意的是ANDA审批并非适用于所有类型的药物,一些生物制剂、新药物以及具有新型剂型或新途径的药品可能需要通过不同的申请程序。
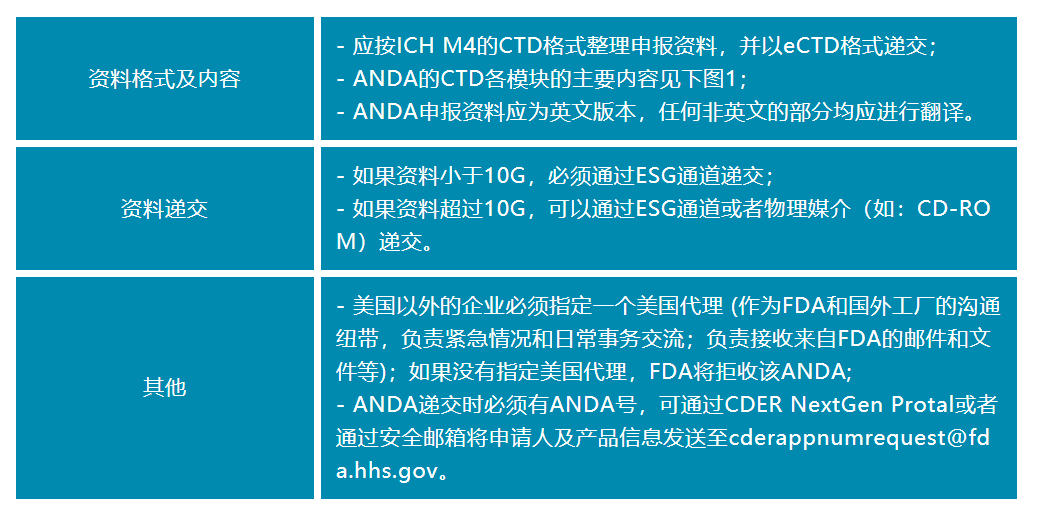
美国食品药品监督管理局(FDA)要求ANDA申报程序一些主要的递交要求:
1. 电子提交:FDA要求所有ANDA申请以电子形式进行提交,符合电子申请的要求和规定。申请人需要使用FDA规定的在线电子提交系统,如电子提交门户(eSubmission Gateway)或电子申请管理系统(eCTD)进行申请的电子提交。
2. 完整性:申请人需要确保所有提交的资料和文件都是完整的,且符合FDA的要求和规定。任何不完整的资料可能会导致延迟或者拒绝申请。
3. 文件格式:所有文件和资料都需要符合FDA规定的文件格式和结构,如eCTD格式。此外,需要确保文档的质量和完整性。
4. 数据和信息:ANDA资料需要包括关于药物成分、生产方法、生物利用度和肯定度等方面的清晰的数据和信息,这些数据和信息需要符合FDA的标准和要求。
5. 申请表格:除了科学数据和信息外,申请人还需要填写特定的申请表格,并提供其他必要的文件和证明材料。
6. 相关申请费用:需要提交相关的申请费用以支持申请处理过程。
申请人需要严格遵守FDA的规定,并确保所有资料和文件的完整性、准确性、清晰性、可追溯性和规范性,以促进ANDA申请的审批流程顺利进行。
美国ANDA的申报内容:
1. 申请表格:申请人需要填写FDA指定的申请表格,包括FDA Form 356h等。
2. 法律声明:申请人需要提供与申请相关的法律声明,包括关于仿制药与原创药的比较和类似性等方面的声明。
3. 化学药物成分:包括详细的药物成分、稳定性、制造工艺等信息。
4. 生物利用度研究:申请人需要提供与原创药物的生物利用度研究相关的数据和信息。
5. 采用的测试方法:包括与原创药物的测试方法相关的信息,确保其与原创药物的测试方法保持一致。
6. 标签和包装:ANDA申请需要提供与原创药物一致的标签和包装信息。
7. 成品测试结果:包括原创药物和仿制药成品测试结果的比对。
8. 设施和设备信息:包括与制造过程和生产工艺相关的设施和设备信息。
这些是一般情况下所需的ANDA申报内容,不同类型的仿制药可能需要提供不同的详细信息。在申报ANDA之前,申请人应咨询FDA发布的指南,并按照指南要求提交相关的申请资料。
ANDA审评流程:
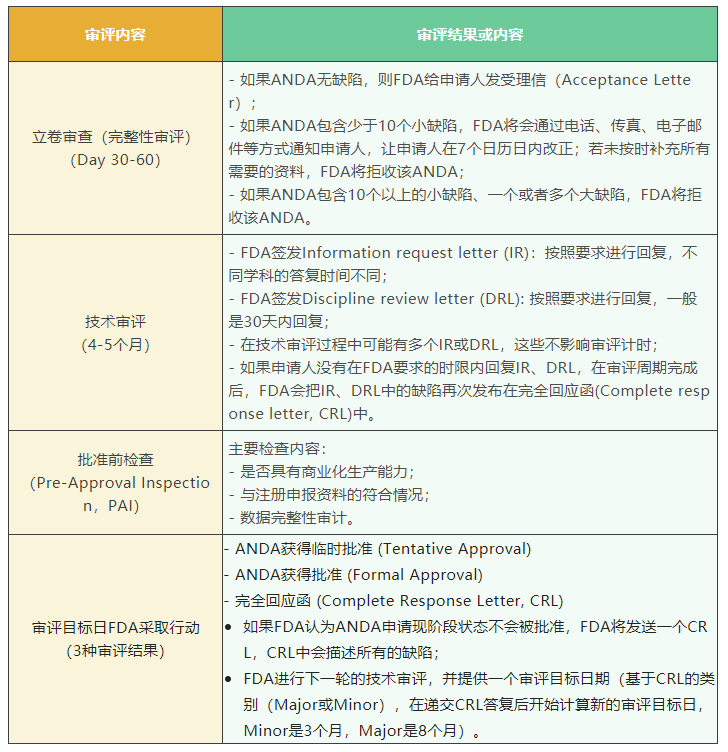
获得FDA对ANDA批准,是国内仿制药进入美国市场的前提条件。各ANDA申请人应熟悉并灵活运用FDA发布的各项指南要求,不断提高ANDA申报资料的质量并积累经验,将ANDA的审评时间线把握在自己手中,才能在计划的时间获得产品的批准准及上市。










