食品FDA认证_什么是NDI新膳食成分?
什么是 NDI 新膳食成分?
什么是“新的膳食成分”?术语“新膳食成分”是指1994 年 10 月 15 日之前未在美国以膳食补充剂形式销售的膳食成分。
在此日期之后进入商业流通的任何膳食成分都需要向 FDA 提交上市前通知。这是通过在将膳食成分投放市场前至少 75 天提交 NDI 通知 (NDIN) 来实现的。
提交的复杂性要求申请人举例说明并证明膳食成分作为膳食补充剂或在膳食补充剂中的预期用途是安全的。据估计,FDA 每年收到大约 50 个 NDIN,该机构承认市场上有许多非法销售的成分。因此,这种市场波动促使 2016 年制定了新指南,以帮助更好地说明何时需要 NDIN 以及 FDA 对安全数据的建议。

提交文书工作相当繁杂,2016 年指南中提出的新修订有效地使程序更加混乱。我们在深圳的专家团队可以通过协助提交组件或整个文书工作来帮助您的公司完成这个复杂的程序。
我们的服务包括:
1.确定您的成分是否是新的膳食成分
2.执行文档差距分析并概述所需的任何其他数据
3.完成新膳食成分通知 (NDIN) 的完整档案
4.申请并准备 FDA 提交前会议
5.在通知过程中解决 FDA 的任何问题或澄清要求
定义膳食补充剂和成分:
21 USC 321(ff) 将“膳食补充剂”定义为烟草产品以外的任何产品,旨在补充膳食并包含“膳食成分”。该定义仅限于不被视为常规食品或可被视为膳食或饮食的可摄入产品(例如,片剂、胶囊、软胶囊、粉末、液体等)。任何目前已获批准的药物或生物制品,或任何获准进行调查的药物或生物制品均不属于此类别,除非相关产品在获得监管批准或授权之前已作为膳食补充剂上市销售。
在 21 USC 321(ff)(1) 中“膳食补充剂”的定义中,“膳食成分”被描述为:
1.一种维生素;
2.一种矿物;
3.药草或其他植物;
4.一种氨基酸;
5.一种膳食物质,供人类通过增加总膳食摄入量来补充膳食,
6.上述任何成分的浓缩物、代谢物、成分、提取物或组合。
新膳食成分 (NDI) 通知的简要说明:
根据 FDA 的膳食补充剂:
新膳食成分通知和相关问题:行业指南,NDI 通知必须在产品上市前至少 75 天提交。此外,提交 NDI 通知的新膳食成分或补充剂的分销商或制造商必须向 FDA 提供信息,该信息已告知申请人的依据,以得出结论认为含有 NDI 的膳食补充剂在该条件下将被合理预期是安全的。产品标签上详述的推荐或建议用途。此信息需要包括对已发表文章的任何引用。
如果出现以下情况,FDA 将认为含有 NDI 的膳食补充剂是掺假的:
1.未向 FDA 提交所需的上市前通知,
2.没有使用历史或其他证据表明,当按照产品标签上的推荐或建议使用 NDI 时,即使已向 FDA 提交了所需的通知,也可以合理地预期它是安全的。
3.制造商/分销商有责任评估其膳食补充剂产品中使用的膳食成分,并确定是否有必要提交 NDI。如果对某种膳食成分是否被视为新膳食成分存在不确定性,仍可向 FDA 提交 NDI 通知。无论提交要求如何,制造商/分销商仍有责任确保他们的膳食补充剂安全且不含杂质。
NDI 上市前通知:必填信息
FDA 的 NDI 法规规定了制造商和/或分销商必须在上市前 NDI 通知提交中包含的信息 (21 CFR 190.6(b)):
1.提交 NDI 通知的制造商或分销商的名称和完整地址;
2.作为上市前通知重点的 NDI 的名称,以及
如果 NDI 是植物药,则必须包括其拉丁二项式名称以及为该物质提供拉丁二项式名称的科学家的姓名;
3.包含 NDI 的膳食补充剂的描述,包括:
膳食补充剂中的 NDI 水平,以及
补充剂标签上的推荐或建议使用条件,或者如果标签中没有推荐或建议使用条件,则为补充剂的一般使用条件;
4.使用历史或其他安全证据表明,当在补充剂标签上规定的推荐条件下使用时,可以合理地预期膳食成分是安全的,以及制造商或分销商授权代表其签署通知的人员的签名。

NDI常见问题解答:
不是膳食成分的物质可以成为 NDI 吗?
否,在仔细审查“新膳食成分”的描述后,很明显该定义适用于 1994 年 10 月 15 日之前未在美国上市的膳食成分。因此,一种物质必须是膳食成分才能被符合新的膳食成分分类的条件。
用于制作 1994 年 10 月 15 日之前上市的传统食品的成分是否属于 NDI?
这个问题的答案比先前的查询更复杂,而且,本质上,它取决于。仅在 1994 年 10 月 15 日之前,一种成分已用于常规食品的事实并不能确定该成分是否为 NDI。相反,重要的是相关成分是否在同一时间范围内作为膳食成分销售。该成分必须在 1994 年 10 月 15 日之前在美国作为膳食补充剂销售,或用于膳食补充剂中。
简而言之,该成分被视为 NDI,除非它在 1994 年 10 月 15 日之前在美国也作为膳食成分销售。
什么是“NDI 掺假标准”?
NDI 掺假标准载于 21 USC 342(f)(1)(B)。美国法典的该部分规定,任何含有 NDI 的膳食补充剂都被认为是掺假的,除非有足够的信息可以合理地保证 NDI 不会造成重大或不合理的疾病或伤害风险。
如果不需要 NDI 通知,掺假标准是否仍适用于含有 NDI 的膳食补充剂?
是的,掺假标准适用于所有含有 NDI 的膳食补充剂,即使不需要 NDI 通知。这是因为补充剂仅包含食品供应中存在的膳食成分,并且这些成分已以没有对食品进行化学改变的形式用于食品。
当 FDA 指南提到“营销”一种膳食成分时,它的意图是什么?
FDA 考虑以下情况以满足“营销”膳食成分的描述。
当一种成分被出售或出售时:
1.作为或在膳食补充剂中;
2.散装作为膳食成分用于膳食补充剂,
3.作为用于膳食补充剂的膳食成分的混合物或配方中的一种成分。
该成分可以上市销售:
1.在线的;
2.在零售店;
3.在目录或价目表中,
4.通过广告或其他促销,如果促销明确表明该成分可供购买。
5.需要注意的是,“即将推出”广告不符合或不符合 FDA 对“营销”膳食成分的标准。
如果在提交 NDI 通知之前或在提交 NDI 后不到 75 天销售含有 NDI 的补充剂,FDA 是否认为该膳食补充剂或 NDI 是合法销售的?
根据 FDA 的规定,在这段时间内销售产品并不能证明补充剂或 NDI 是合法销售的。
如果一种膳食成分在 1994 年 10 月 15 日之前在美国境外销售,它是否仍被视为一种新的膳食成分 (NDI)?
是的,不能通过向 FDA 提供证明该成分在 1994 年 10 月日期之前在任何其他国家/地区销售的文件来确定该成分不是 NDI。唯一一种被 FDA 认可和接受的关于膳食成分是否为 NDI 的营销是 1994 年 10 月 15 日之前在美国境内进行的营销。
FDA 推荐的文件示例有哪些,以证明一种膳食成分在 1994 年 10 月 15 日之前在美国上市?
根据 FDA 指南,证明膳食成分不是 NDI 的文件应包括:
1.书面业务记录;
2.宣传材料,
3.日期早于 1994 年 10 月 15 日的新闻报道。
这可以包括:
1.销售记录;
2.提单;
3.销售合同;
4.制造记录;
5.商业发票;
6.杂志广告;
7.邮购目录,
8.销售手册。
重要的是要记住,文件应包含足够的信息来确定营销发生在美国。为了证明这一点,提供给该机构的营销材料应明确说明:
1.上市成分的身份(例如化学或植物名称);
2.其形式(例如磨碎的药草、水提取物、油等),
3.该成分是作为膳食成分销售还是用于其他目的。
下图信息可帮您确认是否需要NDI:
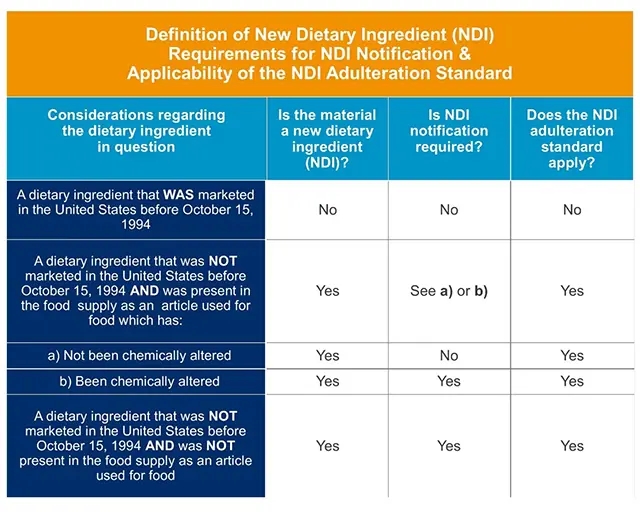
新膳食成分的定义、NDI 申报要求和 NDI 掺假标准的适用性
商通检测拥有丰富的经验和专业知识,综合服务于整个产品生命周期,从产品开发菌落测试、认证备案、稳定性,为膳食补充剂和营养保健品提供广泛的服务。










