FDA如何判断软件变更何时需要新的510(K)
美国食品和药物管理局(FDA或机构)是医疗器械和其他保健产品领域的美国监管机构,已发布了一份指导文件,专门用于决定何时提交510(k)以对现有的软件进行更改设备。
该文件的新版本于2017年10月发布,除了对适用原则的总体概述外,该文件还详细描述了责任方应如何做出此类决定。值得一提的是,由于其法律性质,该指南本身并没有引入额外的要求,而是提供了所有相关方考虑的澄清和建议,以确保和保持遵守适用的监管要求。此外,可以应用替代方法,前提是它符合现行立法并已事先获得FDA的批准。
特别是,该指南描述了责任方应如何决定对已投放市场的医疗器械的软件更改是否应被视为重大,从而要求正式提交新的510(k)上市前通知。该文件中描述的方法被认为对所有参与医疗器械操作的各方来说是负担最轻的。该文件还包含对FDA认可的自愿共识标准的参考,医疗器械制造商在证明在安全性和性能方面符合适用的监管要求时可能会参考。

应用方法:
为了协助医疗器械制造商应用主要原则在其中概述,该文件提供了一个流程图,并附有额外的说明和示例,旨在指导责任方就是否需要新的上市前通知510(k)做出决定,该通知与已对医疗设备进行的软件更改相关获准在美国销售和使用。据称,所提供的方案无法涵盖与此类变化相关的所有可能的复杂性以及它们如何影响决策,因此它仅描述了建议的一般方法。因此,在确定新的上市前通知510(k)的必要性时,医疗器械制造商应考虑指南中提供的一般原则和流程图,以及文件单独部分中强调的其他因素。
流程图中描述的方法旨在回答有关对现有医疗设备进行软件更改的特定问题。它旨在指导制造商根据所做更改的性质确定是否需要重新提交。根据一般规则,制造商应根据与批准上市和使用的初始医疗器械的比较做出决定,并评估软件更改将如何影响其安全性和性能。根据该指南,当变更(或多个变更)超过21CFR807.81(a)(3)阈值时,制造商必须提交新的510(k),例如,它“可能显着影响设备的安全性或有效性,”或构成“设备预期用途的重大变化或修改”。原子能机构强调,在某些情况下,一个单一的变化可能构成许多可能导致积极或消极影响的变化。为了帮助应用这种方法,FDA还提供了医疗器械制造商可能使用的几个理由(理由)示例。
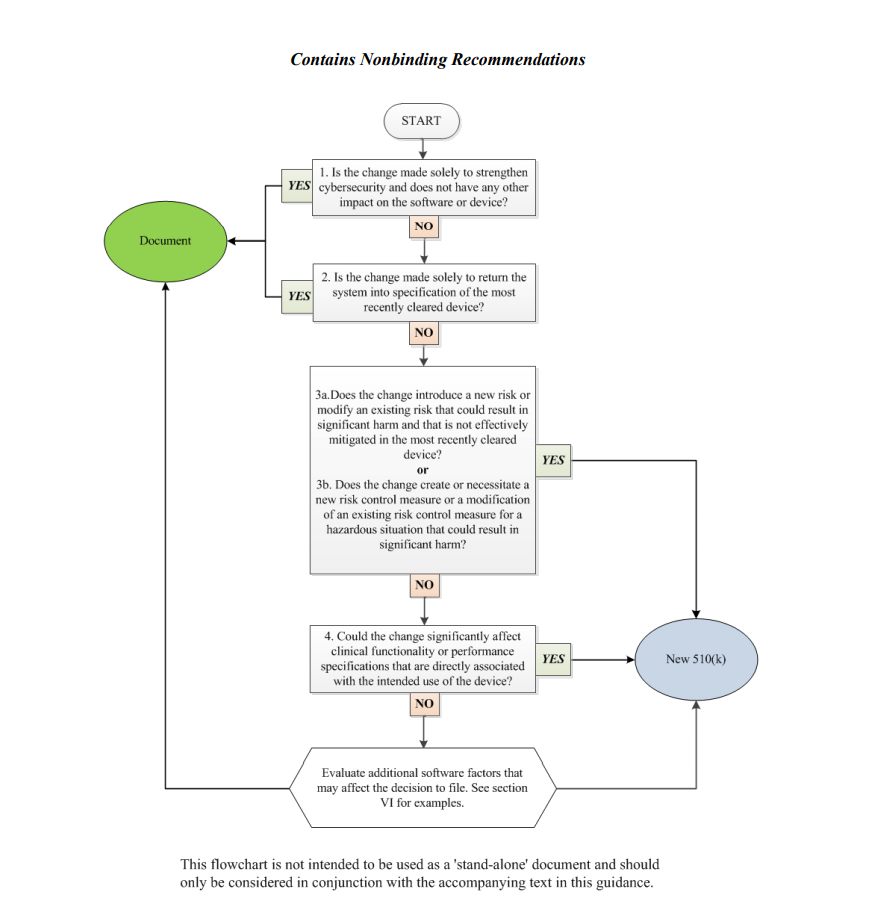
决策过程:流程图
在流程图描述的决策过程中,医疗器械生产企业应当回答以下问题:
1.更改是否仅是为了加强网络安全,对软件或设备没有任何其他影响?
根据该文件,大多数专门用于改善网络安全的更改不需要重新提交,只要它们不影响一般医疗设备的安全和性能。但是,如果制造商识别出这种影响,则应继续回答流程图中提供的其余问题以做出决定。
2.更改是否仅仅是为了使系统恢复到最近清除的设备的规格?
在大多数情况下,如果变更的目的仅仅是为了将有问题的医疗器械恢复到已获准上市和使用的医疗器械的规格,则此类变更不需要重新提交,只要此类变更不会造成重大影响对医疗器械的安全性和有效性或其预期用途的影响。对此,医疗器械生产企业应当进行严格的分析,以评估此类变化带来的影响。据称,在软件需求缺失或不明确的情况下,将需要按照流程图执行进一步的步骤。
3.变更是否引入了新的风险或修改了可能导致重大危害且在最近清除的设备中未得到有效缓解的现有风险?
在这方面,制造商应确定对软件所做的更改是否会导致与医疗器械相关的风险发生某些变化。根据该文件,如果软件变更产生了新风险、修改了现有风险、使与风险相关的潜在危害更加严重,或者如果现有设备中存在问题的风险没有得到适当缓解,则可能需要进一步考虑。
4.对于可能导致重大危害的危险情况,变更是否会创建或需要新的风险控制措施或修改现有的风险控制措施?
如果新引入的风险控制措施可能会影响医疗器械的整体安全性和性能,则需要进行额外的评估。如果此类控制措施对于应对新风险是合理必要的,则需要提交新的上市前通知510(k)。同时,如果新的风险控制措施旨在改进现有的风险控制措施,则不需要重新提交,前提是后者足以降低与设备相关的风险。
5.变更是否会显着影响与器械预期用途直接相关的临床功能或性能规格?
如果对现有医疗器械所做的软件更改影响其临床性能,则需要提交新的上市前通知510(k)。
除了回答上述问题外,医疗器械制造商还应评估可能影响提交新上市前通知510(k)决定的其他软件因素。
总之,目前的FDA指南详细描述了医疗器械制造商在决定对现有医疗器械的软件更改是否需要提交新的510(k)时应用的方法。为此,该文件提供了一个流程图,描述了为做出此类决定而应遵循的分步程序。
资料来源:
https://www.fda.gov/regulatory-information/search-fda-guidance-documents/deciding-when-submit-510k-software-change-existing-device










