FDA认证豁免手套等低风险医疗器械永久性510(k)
手套等一批医疗器械豁免510(k):
美国食品和药物管理局已从510(k)上市前通知要求中永久豁免了七种类型的低风险医疗器械,并已提议对其他几种器械采取类似的豁免措施,以在COVID-19公共卫生紧急情况下扩大对这些产品的使用范围。确定的设备
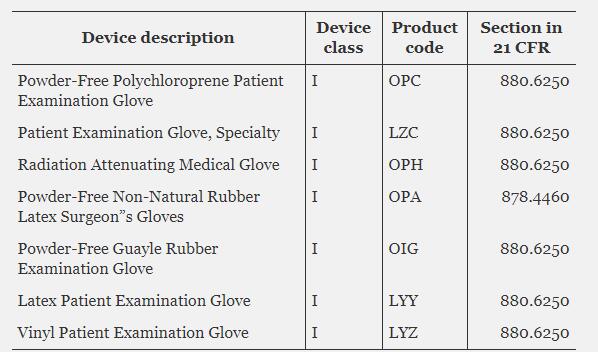
根据FDA认证最近的通知,永久免除510(k)要求的七种I类设备类型包括手术手套和检查手套;这些豁免于2021年1月15日生效。
针对其他II类设备的510K豁免:
此外,该机构还建议永久豁免83种II类设备(以及一种未分类的设备)的510(k)注册要求;这些设备上缺乏不良事件报告数据,导致FDA认证认为没有必要进行上市前通知。监管机构已针对这些拟议的进一步豁免规定了60天的评论期。
永久510(k)豁免提案针对的设备类型包括广泛的产品和系统:
家用呼吸机,气道监控系统,OTC心电图仪软件,空气净化器和清洁器,医疗设备清洁器,N95呼吸器和充氧器。
FDA认证通知表6提供了II类和未分类设备的完整列表,这些设备被确定为豁免产品。
这些新的和提议的510(k)豁免措施不仅支持增加公众对冠状病毒大流行期间所需设备的公共访问,而且还将使FDA认证能够将监管审查资源专用于更多关键任务领域,包括用于抗击COVID-19的设备和技术。
立即免除510(k)通知要求的I类设备:
关于FDA豁免通知表可查看:
https://www.federalregister.gov/documents/2021/01/15/2021-00787/making-permanent-regulatory-flexibilities-provided-during-the-covid-19-public-health-emergency-by#p-64
商通检测提供产品FDA认证注册服务,510K注册,otc注册等,相关产品认证可咨询商通检测快速办理!









