药物FDA认证2021财年注册费–OTC专论药物年费多少
FDA认证已经公布的OTC专着药用户收费的财年2021 FDA指OTC专着药用户收费计划,作为“OMUFA ”。
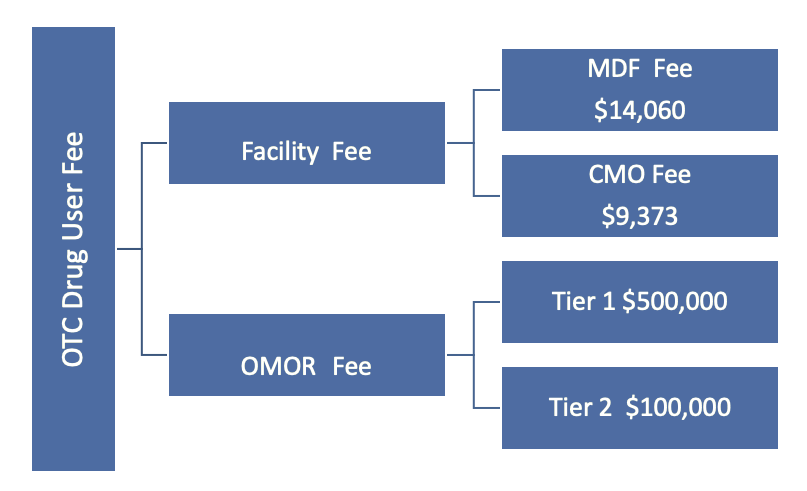
OTC专论2021财年的费用结构:
1级OMOR费用$ 500,000
Tier 2 OMOR费用$ 100,000
MDF设施费$ 14,060
首席营销官设施费$ 9,373
FDA对非处方药收费的解释 :
非处方药(OTC)专论的《吸毒者费用》何时到期?
2021财年的OTC专论药品设施费用应在本联邦公报公告发布后的45天后于2021年2月12日到期。
谁必须支付OTC专着《吸毒者费用》?
从事制造或加工OTC专论药物最终剂型的设施需要支付费用。FDA将评估并收取两种设施的费用。
来自OTC专论药品设施的合格拥有者的设施费用(制造商和合同制造商)。
合格的OTC专着定购请求(OMOR)提交者的费用。
什么是OMOR?
在OTC专论中进行更改的行政命令请求称为OMOR,重大更改(例如,要求添加新的活性成分或适应症)被分类为Tier1 OMOR。要求进行细微更改的请求,例如在药品事实中添加“其他信息”部分,对“说明”部分进行更改,则被分类为Tier 2 OMOR。
专论药物设施的定义:
OTC专论药物设施是从事OTC专论药物成品剂型生产或加工的外国或国内企业或其他实体。该设施也称为专论药物设施(MDF)
合同制造设施的定义:
合同制造组织(CMO)设施是一种OTC专论药物设施,该设施的所有者或所有者的任何附属公司均不将在该设施生产的OTC专论药物直接出售给美国的批发商,零售商或消费者。
将向拥有被标识为MDF的设施的每个合格人员评估全额设施费,并向拥有被确定为CMO设施的每个合格人员评估设施费用的三分之二。
谁免收设施费?
如果OTC专论药品设施在2019年12月31日之前停止了OTC专论药品活动并为此更新了在FDA的注册,则可免除2021财年的设施费。
仅生产OTC专论药物的活性药物成分(API)的设施不符合OTC专论药物设施的定义。
如果某设施执行以下功能,则该设施不被视为OTC专论药品设施:
1.生产临床研究用品
2.测验
3.将外包装放置在包装或包含多种产品的包装上
如何识别设施?
药品企业注册数据库将用于识别合格设施。
FDA利用FDA的电子药品注册和列出系统(eDRLS)来评估合格设施的数量。
如果确定的非处方药专论药品设施:
1.在适用会计年度的前一年的12月31日之前停止了所有与非处方药相关的活动。
2.已更新其eDRLS注册以反映该更改(请参阅《 FD&C法案》第744M(a)(1)(B)(i)条)。
3.原子能机构将评估并向OMOR提交者收取费用,但要求进行某些与安全相关的更改的OMOR除外。根据存在争议的OMOR是1层还是2层,OMOR费用有两种级别。
费用如何支付?
应通过创建用户费用封面页来支付OTC药品费。商通检测可以帮助您创建封面并支付FDA费用,请与我们联系以获取更多信息。










