什么是FDA认证DMF?美国FDA DMF申报
FDA认证DMF归档要求(药品主文件)
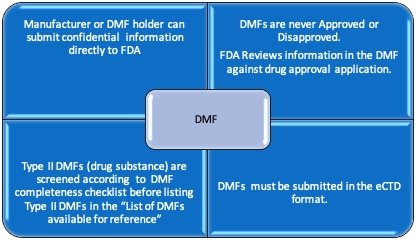
DMF代表药品主文件,其中包含与产品制造,控制或化学有关的机密信息。美国DMF备案是美国FDA认证为维护DMF申报中信息的机密性而做出的规定。药品,赋形剂或包装材料的制造商可以将与产品相关的机密信息直接提交给FDA,而无需向其客户披露。但是,制造商可能必须向其客户披露DMF的某些部分,例如产品规格和一般信息,因为此类信息对于产品开发和质量控制相关活动是必不可少的。
在对DMF的生产厂家提交DMF到了FDA和提供授权他们的客户的姓名字母。在FDA审查DMF与连接一个药物的应用,如ANDA / NDA / ANADA。换句话说,在FDA不审查的DMF作为独立的,因为期间的DMF审核中,FDA认为因素,产品力,产品的性质,及每日最大剂量。因此,DMF既不被批准也不被拒绝。
II型DMF的完整性评估:
FDA认证根据FDA发布的完整性评估清单对II型药物主文件进行初步评估,以验证II型DMF中是否存在强制性必需信息。成功完成完整性评估后,FDA将此类DMF发布在“可供参考”清单中,该清单为仿制药申请人提供了其供应商提交的DMF保证。
为了通过FDA完整性评估,必须根据FDA DMF准则准备DMF,并且必须包括所有强制性信息。
eCTD DMF
这是一个强制要求提交该DMF在的eCTD格式。eCTD是一种电子通用技术文档,其中包含xml主干以及根据ICH eCTD规范组织的元数据和eCTD文档。
在FDA保持的DMF文件,名称和列表DMF号为所有已完成行政审查可以在产品中发现在FDA的DMF数据库,FDA的DMF列表按季度更新,新提交的DMF。
关于FDA认证DMF的事实:
1.DMF归档不是强制性的
2.DMF归档是直接将信息提交给FDA而不向您的客户披露信息的规定。
3.DMF既不被批准也不被拒绝。FDA审查了DMF是否与引用DMF的药物应用有关。
4.FDA DMF号不构成FDA批准
5.如果DMF有任何变更,药品主档案持有人必须提交修订,并每年提交一份报告。
商通检测为DMF归档服务提供服务,包括DMF修订和年度报告。
请与我们联系以获取更多信息。










