FDA医疗软件预认证试验计划
美国食品和药物管理局(FDA认证)是医疗器械和其他保健产品领域的美国监管机构,它宣布了对软件预认证试验计划的新改进和修正。

FDA认证前试点计划简介:
根据FDA发布的官方信息,软件预认证(预认证)试点计划是一个特殊项目,旨在将来开发医疗软件监管框架。尤其是,FDA打算加快将软件作为医疗设备(SaMD)投放市场之前要执行的监管程序,同时确保其完全符合适用的安全和性能要求。
新框架还应减轻医疗器械制造商和FDA不必要的监管负担。主管部门强调,为了满足适用的标准,具有预期医疗目的的软件制造商(开发人员)应表现出强大的质量文化和组织卓越性。制造商还必须建立并维护对提供给消费者(包括医疗保健专业人员和患者)的软件产品的实际性能进行持续监控的系统。
因此,根据“预认证试点计划”引入的监管方法,FDA将不仅关注SaMD本身,而且还将关注制造商建立其内部流程的方式。原子能机构指出,在新框架下,与制造商相关的因素比与上述医疗软件相关的因素更为重要。为了满足资格标准,在向客户提供其产品之前,应预先认证医疗软件制造商(开发人员)。
另一个要点涉及修改和改进。FDA强调,由于其性质,可以在短时间内对软件产品进行修改和修改。这些功能使医疗软件开发人员可以在对医疗软件的安全性和性能存在某些担忧的情况下快速实施必要的更改。根据原子能机构的立场,对软件的不良事件和错误做出如此迅速的反应对于确保市场上始终可获得的产品始终满足适用的安全和性能要求非常重要。
FDA认证在2019年初启动了该项目的第一个迭代,即Pre-Cert 1.0。最初的试点测试仅限于SaMD产品的制造商。现在,原子能机构打算扩大试行预审项目的范围,以涵盖医疗设备(SiMD)中的软件和其他软件产品,包括旨在与硬件医疗设备一起使用的软件产品。
软件预认证计划:重点
1.为了简化预认证试点计划的开发,FDA已开发了软件预认证试点计划工作模型(当前版本为1.0)。该文件概述了新项目的最重要特征,描述了拟议框架的主要内容,并解释了新方法可以改善现有监管程序的方式,以确保医疗保健专业人员和患者可以使用安全有效的医疗软件。
2.如前所述,软件预认证计划的初始测试于2019年初开始,当时机构发布了适当的测试计划,描述了与现有程序相比用于评估新监管框架的实际绩效的方法。
3.2020年下半年,原子能机构发布了更新,其中提供了开发过程的摘要,以及在测试过程中获得的结果以及以下步骤。
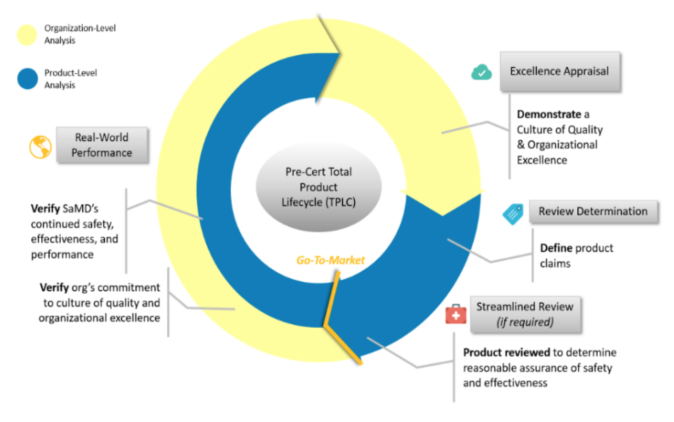
4.认证前试点项目实施了总产品生命周期方法(TPLC),以便在软件生命周期的任何阶段建立对软件性能的连续监视。
TPLC包含以下关键要素:
1.卓越评估:
确定机构在评估医疗软件制造商(开发人员)进行预认证的资格时将使用的特殊标准。当前版本的“预认证试点计划”采用五个主要标准:患者安全,项目质量,临床责任,网络安全责任和积极进取的文化。还必须提及的是,实际上要实施两个级别的预认证:评估对上文概述的卓越原则的遵守情况,以及制造商申请认证以提供跟踪记录的能力。
2.审查确定:
在预认证框架下,允许制造商确定其产品本身的监管途径。特别是,可以通过简化(通知)程序将低风险软件产品投放市场,前提是仅通知FDA有关将该软件投放市场就足够了,而高风险产品则需遵守相关法规。进行必要的适当评估和评估,以确保它们满足适用的安全和性能要求。在应用此原则时,FDA将使用由国际监管机构自愿组织国际医疗器械监管者论坛(IMDRF)开发的风险分类。
3.简化审核:
机构将制定一种特殊方法,以便在确定首次提交时确定医疗软件制造商(开发人员)提供的信息范围时使用。
4.实际性能:
根据新方法,医疗软件制造商应收集和分析与其投放市场的软件产品的实际性能相关的信息,以便能够识别安全问题和不良事件,并相应地进行更改和修改。在现阶段,原子能机构仍在考虑所有可供选择的最有效方法的选择。
认证前试验计划目的
根据官方公告,新的软件预认证计划旨在为医疗软件引入新方法,改善与之相关的程序,并减轻监管负担。
整个概念基于三个要点:
1.透明度,
2.信任,并且
3.验证。
原子能机构还概述了“预认证试点计划”的主要目标,即:
1.为经过预先认证的医疗软件制造商创造收益,使其能够以简化和加速的程序将其产品投放市场,
2.利用与医疗软件的安全性和性能有关的数据改善运营,
3.实施变更和修改的新方法,
4.确保允许在美国销售的所有软件产品均符合适用的安全和性能要求,
5.根据应用程序过程中收集的信息对程序本身进行持续改进。
总结以上提供的信息,由FDA发布的有关“预认证试点计划”开发的更新描述了新框架的最重要方面以及该项目的当前状态。该文档概述了软件预认证方法的主要功能及其主要原理。










