FDA认证QSIT:了解医疗器械QMS检查期间会发生什么
与大多数其他国家/地区的监管机构不同,美国食品药品监督管理局(FDA认证)依靠随机检查来保持医疗器械制造商的诚实。
随时可能进行随机审核,这意味着制造商必须始终遵守FDA认证质量体系法规(QSR)。
每年都有太多的医疗器械制造商需要FDA认证进行检查,因此FDA认证根据制造商及其设备带来的风险来优先安排有限的检查人员。一些公司比其他公司更受关注。通常,II级和III级制造商可以期望每两年进行一次FDA认证访问。基于风险的方法意味着拥有新的或现有的III类设备的公司是最高优先级,尤其是那些制造可植入并具有生命支持设备的公司。与最近通过510(k)流程推出设备的任何公司一样,第二类制造商(占批量的大部分)也紧随其后。有时,FDA认证将检查风险较高的I类制造商。
FDA认证检查的提前通知以及接下来发生的事情
通常,FDA认证将在检查前至少5天通知美国制造商。外国公司通常会提前得到通知,以便安排旅行和翻译。在检查之前,FDA认证可能会要求您将质量体系手册和管理审查程序的副本发送给他们,以促进检查。您无需发送这些文件,但是如果拒绝发送,则可能会使检查人员陷入困境,以为您有隐藏的东西。
当FDA认证检查员到达时(根据公司的规模,可能会有不止一个),他们将出示证章并要求与最高管理人员会面。虽然可以写下他们的姓名和徽章编号,但您不得拍照或复制他们的徽章。然后,他们将提交482表“检查通知 ”作为正式手续,并举行一次开幕会议,以了解有关您公司和产品的结构的更多信息,然后进行一次工厂参观。
FDA认证 QSIT方法论解释了
QSIT代表质量体系检查技术,它描述了FDA认证处理质量管理体系(QMS)的方式。这种方法着重于检查过程,然后检查与它们相关的记录。要了解其内容和方法,请研究108页的QSIT手册,该手册旨在指导FDA认证现场人员并与可能参与检查的其他人员共享。它的日期为1999年,但今天仍在使用。
QSIT流程着重于四个主要子系统(如下蓝色所示),最终的问题是:管理团队是否提供了必要的资源来建立和维护有效的QMS?通过与四个主要子系统的链接来检查其他三个子系统。所有七个子系统都围绕管理控件运行。
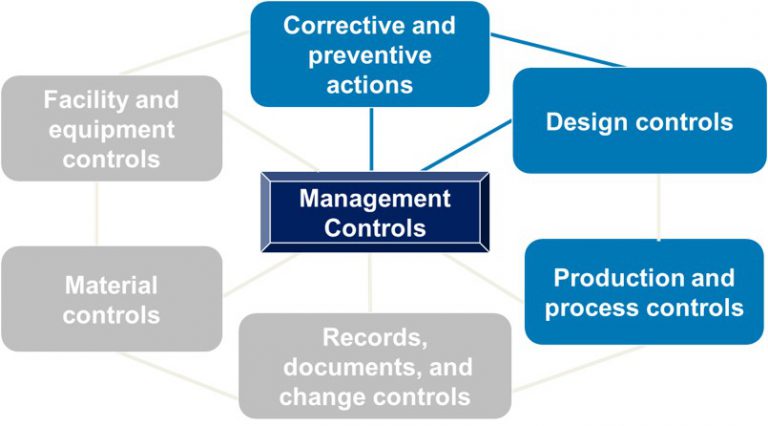
FDA认证 QSIT检查的三个级别
如果这是您首次进行FDA认证审核,则检查员将涵盖所有四个子系统。在随后的常规检查中,检查员将覆盖CAPA以及一个附加子系统。正如FDA认证在2019年指导文件草案中所解释的那样,典型检查预计将持续3-6个工作日。FDA认证应在通知您即将进行的审核时告诉您检查将持续多长时间。
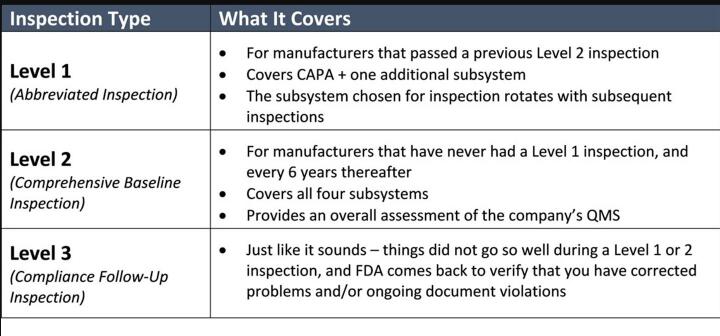
FDA认证检验员在QSIT审核中正在寻找什么
它从对您的程序进行审查开始,然后深入到相关记录的随机抽样中。(如果您喜欢统计数据,并且想了解FDA认证将审查的样品数量,您将享受 QSIT手册的第103-107页。)FDA认证检查员将不会审查您的内部审核报告,供应商审核报告或您的管理人员审查会议记录,除非他们提出书面要求。但是,他们将检查以确保您具有这些文件。
如下表所示,虽然检查是有条不紊的,但检查员如果发现需要关注的地方,可能会做得更深入。在进行检查时,他们会指出483表实时观察。这些问题比“讨论项目”更令人关注,后者已记录在最终报告中,但以后可以提升为观察结果。您可以期望FDA认证检查员每天与管理团队举行会议,以披露当天发现的信息。




FDA认证 QSIT检查结论会发生什么?
在对您来说肯定是一个辛苦而又压力大的一周的结论之后,研究人员将与管理层见面,以复审所有观察和讨论要点。检查人员将为管理层提供捍卫或澄清其职位的机会,并将一切内容记录在企业检查报告(EIR)中。您的检查日期和状态(而不是实际的EIR)将在一周内在FDA认证网站(此处)上发布。这里最重要的字段是“分类”,分为三类:
NAI-未指示任何操作(检查进行得很好,这是您想要看到的内容)
VAI –指示采取自愿行动(检查人员发现了一些问题; FDA认证希望该公司采取纠正措施)
OAI-已指示官方行动(检查人员发现了严重问题;这意味着可能会发出483)
当然,结果并不会让您感到惊讶,因为FDA认证的检查员会在整个检查和日常会议中指出问题。这是有关FDA认证如何发布结论和决定的更多信息。您可以在60天内索取一份EIR副本。如果事情进展不顺利,检查人员可能会签发FDA认证 483表格,您将有15天的时间做出回应。FDA认证可以通过发布警告信使事情更上一层楼,但这越来越罕见。
商通检测提供美国FDA认证服务!










