符合美国FDA认证和EU要求的质量管理体系的关键组件
质量管理过程中的关键参与者
医疗器械公司您需要实施QMS并遵守FDA 21 CFR Part 820和/或ISO 13485:2016,正如我们之前提到的,在世界上大多数地区并不需要ISO 13485,但在许多国家中,ISO 13485无疑是满足QMS要求的“事实”手段。让我们从美国开始,谈谈在维护,审核和认证质量体系中发挥作用的实体。
美国FDA认证和CDRH
美国食品药品监督管理局(FDA)内部是设备与放射卫生中心。该部门通常称为CDRH,负责监管大多数不具有药物或生物成分的医疗设备。当您在美国FDA注册公司时(通常在注册第一台设备时就完成了机构注册),您将处于CDRH检查员的“雷达”上。正如我们前面提到的,FDA进行自己的检查,并拥有阻止或阻止公司在美国市场上销售其产品的法定权力。
欧洲公告机构
主管当局对医疗器械制造商进行检查。您会在NANDO数据库中找到它们。即使公告机构不是政府机构,他们也有权授予或拒绝您设备的ISO认证和/或CE标记。在加拿大,这些称为注册服务商,但几乎所有注册服务商也是公告机构。根据新的MDSAP计划,注册服务商称为审核组织。
如果您正在研究医疗器械质量管理体系的合规性,则可能还会遇到授权代表(欧洲),赞助商(澳大利亚),D-MAH(日本)和美国代理商等术语。例如,如果您是一家在欧洲销售的美国公司,并且在欧洲没有当地办事处,则需要任命该国家(地区)的监管代表。监管代表实际上并未在质量体系的管理或检查中发挥作用,但是,公告机构无疑会进行检查,以确保您在审核过程中拥有一名。
开发您的QMS
如果您想知道从哪里开始为您的组织建立质量管理体系,那么这里是基本阶段。
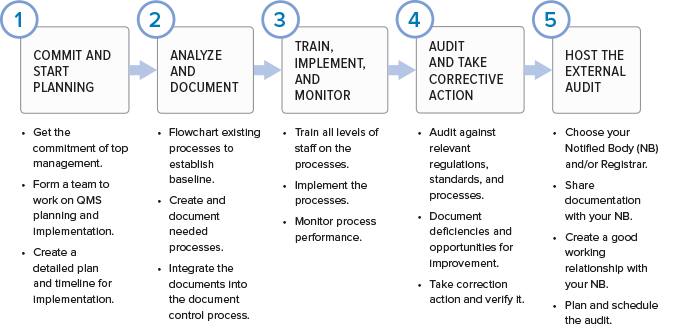
质量管理体系是不断完善的
尽管制定法规管理是创建质量管理体系的原动力,但质量管理体系绝对不是一套存储在硬盘驱动器上的程序,只有当检查员到达时才打开。如果您做的正确,您的QMS应该可以帮助您的业务成功并随着时间的推移而发展。流程将被添加,完善或消除。质量管理体系应该使用过程方法来构建(从而使组织能够计划过程及其交互),并结合基于风险的方法和PDCA周期。
PDCA周期使您的组织能够确保其过程得到足够的资源,在实践中进行管理并针对可能采取的改进机会进行分析。将基于风险的方法与流程管理活动结合在一起,可使您的组织确定可能导致流程和QMS偏离计划结果的因素。
商通检测提供产品美国FDA认证、CE认证和质量体系认证,咨询客服获取详细报价!










