医疗器械FDA认证唯一设备标识符(UDI)
医疗器械FDA认证唯一设备标识符(UDI)
FDA已经建立了独特的设备识别系统,可以通过医疗设备的分发和使用(以人类可读的纯文本和AIDC技术之类的机器可读格式)来充分标记和识别医疗设备。在设备标签和设备包装上以及在某些情况下在设备本身上都要求使用UDI,除非FDA允许例外或替代。如果要多次使用该设备并在两次使用之间进行重新处理,则需要在该设备本身上直接标记UDI。
永久性的UDI可以采用纯文本格式,AIDC技术或两者均可:
1.每个医疗设备(包括所有IVD)的标签都必须具有UDI,I类cGMP豁免设备不需要标有UDI。
2.每个设备包装都必须具有UDI。
3.带有NDC的联合包装组合产品中的设备必须在其标签上带有UDI。
4.独立软件必须在其标签和设备包装以及启动屏幕上带有UDI。
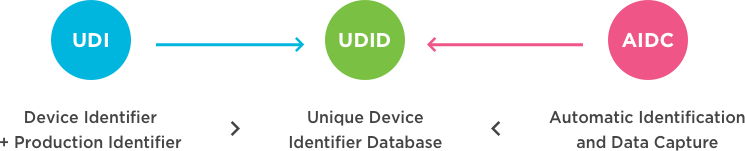
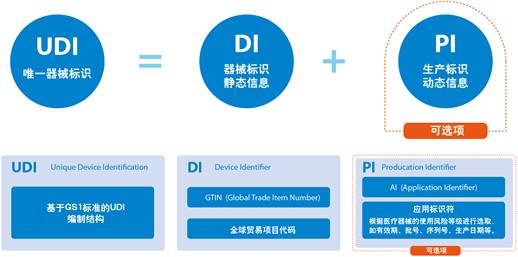
UDI由两部分组成:设备标识符(DI)和产品标识符(PI)
DI(UDI的强制性固定部分):
1.DI标识标签和设备的特定版本或型号
2.分配给特定医疗设备版本或型号的DI不会更改。
3.新版本或型号需要新的DI
PI(UDI的有条件的可变部分):
1.PI包括批号,批次,序列号,到期日期,制造日期和独特的识别码(如果有)
2.每个批次或批次的PI都会更改
3.当标签上有某些信息时,它也应该在UDI中。(第1类设备除外)
FDA认可了三个符合国际标准的签发机构(GS1,HIBCC和ICCBBA)来分配UDI,贴标商可以联系任何经认可的发行机构以获取UDI,每个代理机构分配UDI的费用是不同的。
GUDID提交:
GUDID(全局唯一设备标识符数据库)是一个包含设备标识信息的数据库。GUDID仅包含UDI的DI部分。PI零件未提交或存储在GUDID中。
GUDID提交的合规日期如下:
(1)III类医疗设备-2014年9月24日
(2)植入式,维持生命和维持生命的装置-2015年9月24日
(3)II类医疗设备-2016年9月24日
(4)I类和未分类医疗器械-2018年9月24日
我们在以下方面提供协助:
1.选择适合您要求的经认可的UDI发行机构
2.GUDID提交