第56页
-
fda注册,fda批准和fda之间的差异
FDA是做什么的:FDA的作用和功能 美国食品和药物管理局(FDA)是美国负责保护公众健康的政府机构。FDA监管各种消费品,包括食品、药物、疫苗、医疗器械、放射电子产品、化妆品、兽医产品和烟草。关于FDA监管的完整清单,见本文.FDA的职责是通过确保这些产品的安全性、有效性和安全性来保护公众健康。这意味着产品的使用是安全的,好处大于潜在的风险,它们对制造商声称的预期用途是有效的,而且它们没有被篡改以造成伤害(例如,这就是为什么非处方药有箔封条的原因)。FDA负责许多产品的安全...
-
激光产品的FDA/CDRH登录认证注册号
像亚马逊这样的在线销售商需要美国食品和药物管理局(FDA)通过其在线平台销售的某些激光产品的登录号文件。登录号是FDA用于跟踪辐射电子设备(RED)特定型号的报告的唯一标识符。FDA要求某些红色产品的制造商在其产品在美国销售之前必须有其产品的登录号。所有进入美国的激光产品必须在FDA注册才能合法进入美国:1.在美国,激光安全由属于联邦法律一部分的条例处理(与欧洲不同,欧洲制造商自行认证各种产品标准)。CDRH是FDA的一部分,负责执行相关规定。激光产品的调节被称为21 CFR...
-
激光FDA认证产品分类
FDA定义的激光产品: 使用激光能量的产品有许多尺寸、形状和形式,它们的共同点是一种激光,它储存着一种来源的能量,例如放电、化学反应或强大的光学照明,将能量作为光释放出来。激光代表受激辐射的光放大,一种基本类型的激光由一根装有一对镜子的密封管和一种由某种形式的能量激发产生可见光或不可见的紫外线或红外辐射的激光介质组成。LED(LightEmittingDiodes)不同于激光二极管,不受联邦激光产品性能标准的约束。一种普通的可见光源,如太阳或灯泡,发出一种无形和可见光的混合,...
-
FDA注册510(K)提交的关键信息要求
FDA注册510(K)市场前通知计划的主要目的是医疗设备,这些医疗设备“实质上等同于”其他医疗设备,这些医疗设备此前已获得美国食品和药物管理局(FDA)的市场许可。 在这方面,实质等同是指设备的设计、结构、使用标志、安全性能、有效性和任何其他适用特性等因素。因此,510(K)提交材料所提供的信息的范围和深度必须足以使FDA审查员确定所述医疗设备是否基本上等同于已识别的谓词设备。以下是林业局对所有510(K)份提交材料所要求的具体信息的...
-
产品FDA认证怎么应对工厂审查,需要准备什么?
一些进口商认为他们不受FDA的监管,因为他们把生产外包给了国外的工厂。你可能会问自己,FDA检查我的国外设施的可能性有多大?结果发现几率比你想象的要高得多。 中国制药厂从2011年到2016年,FDA检查的数据增长了66%。美国食品及药物管理局(FDA)将在未来五年内,按照2011年“食品安全现代化法案”(FoodSecurity现代化法案)的规定,每年将其外国食品大多数国家依靠良好的生产实践(GMP)条例来保护消费者免受不安全的产品。像美国食品和药物管理局(FDA)这样的监...
-
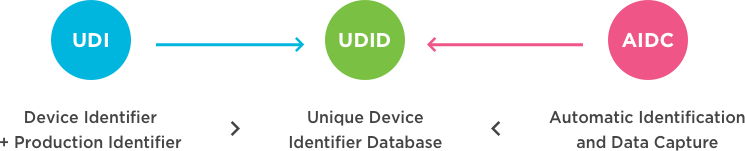
什么是医疗器械唯一设备识别UDI?
什么是UDI? 一种独特的设备识别(UDI)系统旨在通过分发和使用提供单一的、全球统一的医疗设备的阳性标识,要求设备的标签必须具有全球唯一的设备标识符(通过使用自动识别和数据捕获,并在适用情况下使用其人类可读的解释),并根据标准提供UDI-DI(设备标识符),该唯一标识符的UDI-DI(设备标识符)也链接到特定管辖权的公共UDI数据库(来源:国际医疗设备监管机构论坛(IMDRF): 这个美国食品和药物管理局(FDA),欧盟委员会其他监管...
-
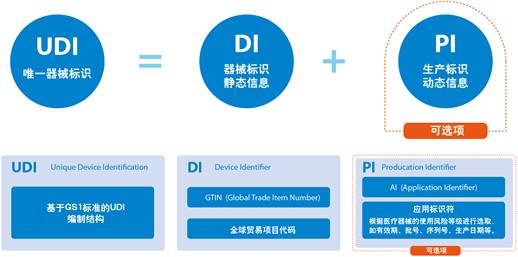
医疗器械FDA认证唯一设备标识符(UDI)
医疗器械FDA认证唯一设备标识符(UDI) FDA已经建立了独特的设备识别系统,可以通过医疗设备的分发和使用(以人类可读的纯文本和AIDC技术之类的机器可读格式)来充分标记和识别医疗设备。在设备标签和设备包装上以及在某些情况下在设备本身上都要求使用UDI,除非FDA允许例外或替代。如果要多次使用该设备并在两次使用之间进行重新处理,则需要在该设备本身上直接标记UDI。永久性的UDI可以采用纯文本格式,AIDC技术或两者均可:1.每个医疗设备(包括所有IVD)的标签都必须具有UD...
-
医疗器械FDA注册上市前通知510K详细介绍
医疗器械FDA注册510K介绍: 医疗器械FDA注册FDA 510(K)是向FDA提交的市场前提交的报告,目的是证明所销售的设备至少与不经市场前批准(PMA)的合法销售的装置一样安全和有效。510(K)提交人必须将其设备与一个或多个类似的合法销售装置进行比较,并提出和支持其实质性的等同索赔。 食品和药物管理局(FDA)内的设备和放射健康中心(CDRH)审查和处理了FDA 510(K)提交的医疗设备。在提交人收到宣布设备SE的命令之前,提交...
-
医疗器械FDA认证I,II或III类设备怎么区分?
美国FDA规范在美国销售的所有医疗器械,这些医疗器械分为三大类。FDA批准的任何医疗器械都将根据其风险,侵袭性以及对患者总体健康的影响分为I,II或III类。但是,这三个类别之间的界限在哪里,为什么? 美国FDA的分类准则可能会使医疗器械制造商对系统的接触程度极度混乱。根据设备的分组方式,制造商的最佳市场开发途径存在巨大差异。与II类或III类设备相比,I类设备受到的法规要求要少得多。通过了解FDA医疗器械类别中的差异,您可以了解如何...
-
化妆品制造机构FDA注册和化妆品产品成分报表(CPIS)备案
化妆品产品成分报表(CPIS)备案: 除化妆品颜色添加剂外,化妆品不经强制性注册和FDA预市场批准,然而,这是化妆品公司的责任,以确保其产品和成分是安全的,并相应地贴上FDA化妆品条例。自愿化妆品注册计划(VCRP)是一个FDA的后市场报告系统,供在美国进行商业销售的化妆品制造商、包装商和经销商使用。 FDA上市公司将协助化妆品制造商或包装者,其产品在商业用途,以登记他们的化妆品机构在FDA(化妆品制造机构注册)。FDA上市公司此外,公...
-
化妆品fda注册标签要求-出口美国
化妆品fda注册标签要求: 正确的标签是销售化妆品或个人护理产品的一个重要方面,标签用于帮助消费者了解产品的预期用途和任何相关警告,其成分和内容的净数量,以及产品的制造或分销地点。美国食品和药物管理局(FDA)在美国食品和药物管理局(FDA)的授权下,对化妆品标签进行了监管。 食品、药品和化妆品法(FD&C法)而公平包装和标签法,这些法律及其相关条例旨在保护消费者免受健康危害和欺骗行为,并帮助消费者对其购买的个人护理产品作出知情决...
-
化妆品FDA注册计划(VCRP)类目怎么划分?
自愿化妆品FDA注册计划(VCRP): 使用此列表确定在fda 2512表格中输入的产品类别代码,每个产品类别代码包括一个两位数的数字(表示一般类别)和一个字母(表示产品的特定类型)。例如,要查找婴儿洗发水的产品类别代码,请注意“婴儿产品”是“01”类,婴儿洗发水被列为“A”项。因此,婴儿洗发水的产品类别代码是“01A”。化妆品FDA注册类目有:01.婴儿用品婴儿洗发水乳液,油,粉末和奶油其他婴儿用品02.沐浴制剂沐浴油、药片和盐气泡浴沐浴胶囊其他沐浴剂03.眼部化妆制剂眉笔...
-
化妆品FDA认证检测项目是哪些?
当消费者按照标签上的说明或习惯或预期的方式使用化妆品时,化妆品必须是安全的,产品测试只是制造商为确保化妆品安全而做的事情之一。有时,FDA进行测试时,我们正在调查可能的安全问题与一个产品,或作为我们的研究计划的一部分。FDA在化妆品测试方面的资源对消费者和行业都是有价值的。化妆品FDA认证检测项目:1.重金属含量测试(Pb,Hg)2.微生物测试3.皮肤刺激性测试4.理化成分分析5.TRA毒理学评估成分标签审核6.防腐功效测试附加测试: 制...
-
食品FDA认证清关需要什么条件?
食品FDA认证清关条件介绍:1.向美国食品和药物管理局(FDA)登记进口食品之前,您需要向FDA注册,进口商和食品生产商作为货物一部分的有关出口国的不法行为也必须登记。FDA批准:你是如何得到这个标签的?FDA批准。这两个词代表着食品行业的一切。那么,你是如何让美国食品和药物管理局(FDA)给你这句话的祝福的呢?请记住,FDA不测试产品或检查食品。食品进口商和食品制造商必须确保他们的设施和工厂在FDA注册,除非他们有不需要的豁免。注册成为FDA设施意味着您的食品过程和产品符合可导致海关批准的要求。进口商可以在这里向...
-
食品罐头公司出口美国(FCE)登记和过程文件(SID)
食品罐头公司出口美国(FCE)登记和过程文件(SID): 美国食品和药物管理局要求生产某些酸化和低酸罐装食品(LACF)包装在密封容器,以获得食品罐头公司(FCE)注册。此外,食品罐头公司必须向食品和药物管理局提交文件,说明在生产符合这些要求的食品时所使用的每一个过程。这些“流程文件”中的每一个都分配了一个唯一的“提交标识符”(SID)编号。 罐头食品(低酸性罐头食品或LACF产品和酸化食品罐头食品)受FDA特别许可管制,这些管制通过F...