第21页
-
什么是21 CFR § 314.420药物主文件?
什么是21 CFR § 314.420药物主文件?21 CFR 314.420(c)是美国FDA(食品和药物管理局)颁布的法规,它涉及药品开发和注册申请中的药品Master File(DMF)或Drug Master File。以下是21 CFR 314.420(c)该法规内容的详细介绍:1. 背景信息 DMF是一种提交给FDA的机密文件,用于提供有关制药原料、包装材料、生产工艺及设备的详细信息。这些文件通常由原料供应商、包装供应商或制药工厂提供,以支持申请人/注册持有人的新药品注册申请(N...
-
dmf注册号怎么查询?美国药物主文件注册公开查询方式
针对DMF注册,美国有专门的公开数据库,你可以在FDA数据库查到国内外原料药企是否进行了DMF备案注册,以及相关备案项目主题、项目编号、注册项目类型、注册时间和申请状态。(申请状态中“A”:激活状态,意味着DMF可用,没有关闭;“I”:未激活状态,意味着DMF被DMF持有者或FDA关闭。)您可以通过以下步骤查询 DMF 注册信息:1. 访问美国食品药品监督管理局 (FDA) 的网站:https://www.fda.gov/2. 在网站顶部找到搜索栏,输入 "DMF"...
-
DMF登记是什么意思,dmf登记号怎么获取?
dmf登记是什么意思? DMF 登记是指将药物主文件 (DMF) 提交给监管机构 (如美国食品药品监督管理局 FDA) 的过程。DMF 是一种包含药物相关信息的机密文件,可供监管机构和其他授权方审查。DMF 登记允许制造商或开发商在不透露专有信息的商业秘密的情况下,向监管机构提交药物相关信息。DMF 登记通常用于以下目的:1. 支持新药申请 (NDA) 或补充新药申请 (sNDA)2.支持仿制药申请 (ANDA)3.支持生物制品许可申请 (BLA)4.支持医疗器械上市前通知 (510(k)...
-
dmf注册流程_资料准备到药物主文件激活要怎么做?
DMF(Drug Master File,药品文献档案)是美国FDA要求的一种非公开文件,用于提交药品、原料药、包装材料、助剂、配方和工艺等有关数据的注册文件。DMF通常由药品原料、药品包装和助剂的制造商或供应商向FDA提交,并用于支持申请商的新药批准申请(NDA)、通用药申请(ANDA)或生物等其他申请。DMF注册的一般流程如下:1. 准备文件:首先,制造商或供应商准备DMF文件,该文件应包括所提交药品或原料的相关信息,如化学结构、制造方法、质量控制、稳定性数据等。2. 提交DMF:制造商或供应商向FDA提交DM...
-
化妆品FDA系统已开放,2024年7月1日之前必须注册完成
美国食品药品监督管理局(FDA)化妆品注册系统于2023年12月18日正式开放!现在可以使用 Cosmetics Direct 门户向美国食品和药物管理局 (FDA) 提交《化妆品监管现代化法案》(MoCRA) 要求的化妆品工厂注册和产品清单。 FDA 还发布了最终指导文件《化妆品设施和产品的注册和列名》,以协助设施注册和产品列名提交流程。最终版本包括包含常见问题和解答的附录。FDA 还发布了更新版本的结构化产品标签 (SPL) 实施指南,其中包含化妆品设施注册和产品清单的验...
-
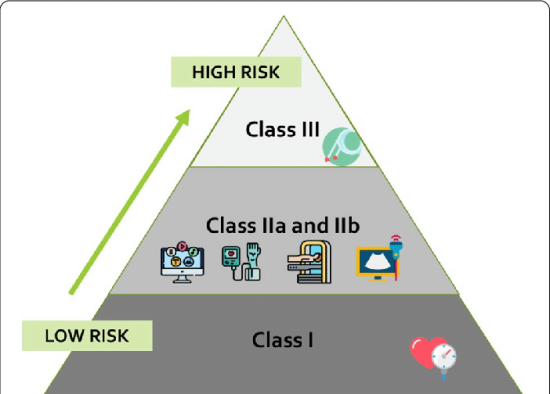
美国FDA和欧盟CE认证医疗器械风险分类
医疗器械风险分类概述 在准备医疗器械进入市场时,考虑医疗器械基于风险的分类可能是成功向监管机构提交的关键。下面,我们探讨了美国和欧盟 (EU) 医疗器械分类的差异(和相似之处)以及每个地区对不同器械分类。FDA如何对医疗器械进行分类? 美国食品和药物管理局 (FDA) 根据对患者或用户的风险将医疗器械分为 I、II 或 III 级风险。设备风险级别通常是通过搜索 FDA 的设备分类数据库来查找“基本等效”的产品来确定的。总之,设备分为以下定义的基于风险的分类。&n...
-
食品出口美国:全面解析FDA认证流程及关键注意事项
在食品行业,出口到美国市场需要通过FDA(美国食品药品监督管理局)的认证。本文将深入探讨食品出口至美国所需的FDA认证,解析认证流程,并提供关键的注意事项,以助力企业在国际市场取得成功。FDA认证的重要性FDA认证是进入美国市场的重要通行证,对食品企业而言具有以下关键意义:1. 合规性保障: 通过FDA认证,企业能够确保其产品符合美国食品法规,提供给消费者的食品是安全合规的。2. 市场准入: FDA认证是进入美国市场的先决条件之一,也是建立信任、拓展市场份额的关键步骤。3. 质量保证: 认证要求企业建立健全的质量控...
-
解析DMF认证:全面了解Drug Master File认证的意义与流程
在医药行业,DMF认证(Drug Master File认证)是一项至关重要的程序,直接关系到制药企业的产品注册和市场准入。本文将深入探讨DMF认证的意义、流程以及相关注意事项,帮助企业更好地理解和应对这一关键性认证。DMF认证的意义 DMF是由美国FDA(美国食品药品监督管理局)提供的一种机密的文件,旨在向FDA提交一系列关于生产工艺、成分、质量控制等方面的详细信息。DMF认证是制药企业为向FDA提供这些信息的过程,具有以下几个重要意义:1. 注册支持: DM...
-
美国FDA提出抗菌创面和液体创面清洗的医疗设备分类
美国食品和药物管理局(FDA)建议将含有抗菌剂和(或)其他化学品(未分类、预先修正的设备)的某些伤口包扎和液体伤口清洗剂分为第二类或第三类医疗设备。FDA计划建立以下三种伤口包扎和液体伤口清洗的分类,即抗菌剂的作用仅限于作为产品的防腐剂或保护剂,而不限于伤口本身:1.含有抗菌剂和(或)其他化学品的固体伤口绷带当使用的目的是覆盖和保护伤口,吸收渗出物,并在伤口内保持适当的湿度平衡。2.作为含有抗菌剂和/或其他化学品的凝胶、乳霜或软膏而制备的伤口膏当使用目的是在伤口内保持适当的湿度平衡时。3.液体伤口清洗一种水基溶液,...
-
DMF授权信是什么?客户要求DMF授权信(LOA)怎么办?
DMF授权信是什么? DMF(Drug Master File)授权信是一封由制药公司(申请者)向其客户(药品制造商、注册申请者等)发出的信函,其中授权对方引用或参考申请者提交给FDA的DMF文件。DMF授权信是为了确保在注册申请时,制药公司可以使用其DMF作为支持文件,而无需将DMF的详细信息公开。 通常FDA不会单独审评DMF,仅当索引该DMF的授权方在其申报资料 (DMF、ANDA、NDA及IND)中递交了一个DMF持有人签发的LOA,且DMF持有人同时将该...
-
DMF文件目录_药物主文件包含了哪些信息资料?
DMF 指的是 Drug Master File,中文翻译为“药品主文件”或“药品大师文件”。DMF 是由美国食品药品监督管理局(FDA)接受并存储的一种非公开的文件,其中包含了制药厂商提交给 FDA 的有关制药工艺、原材料、成分、包装等方面的详细信息。由第三方公司代理申报给FDA审核,审核完成后获得DMF备案编码。DMF(Drug Master File)文件目录的具体内容可能因制药公司和药品类型而有所不同,但通常包含以下基本信息。DMF 文件目录的结构可能根据 DMF 类型和 FDA...
-
DMF申报是什么,美国DMF申报有几种分类,药物主文件备案流程介绍
美国DMF申报是什么意思? DMF 指的是 Drug Master File,中文翻译为“药品主文件”或“药品大师文件”。DMF 是由美国食品药品监督管理局(FDA)接受并存储的一种非公开的文件,其中包含了制药厂商提交给 FDA 的有关制药工艺、原材料、成分、包装等方面的详细信息。由第三方公司代理申报给FDA审核,审核完成后获得DMF备案编码。DMF 的主要目的是允许制药厂商向 FDA 提交其用于生产药品的关键信息,而无需将这些信息公开。这使得制药公司能够保护其专有信息,同时仍然能够符合 F...
-
欧盟EU GMP认证咨询-协助EDQM、EMA审查协助指导
什么是EU GMP认证? EU GMP体系认证是指欧盟药品管理局(European Medicines Agency,EMA)对药品生产企业进行的一项认证。EU GMP(European Good Manufacturing Practice)是欧盟药品管理局制定的一套药品生产质量管理的标准,旨在确保药品的质量、安全和有效性。 EU GMP体系认证要求企业建立和实施一套完整的质量管理体系,涵盖从药品生产过程中的原材料采购、生产工艺控制、设备和设施管理、产品质量控制...
-
美国FDA cGMP认证咨询-资深顾问辅导六大体系实施
美国FDA cGMP认证介绍: 美国FDA cGMP认证是指美国食品药品监督管理局(FDA)的当前Good Manufacturing Practice(cGMP)认证要求。cGMP是一套制药和医疗器械行业的质量管理要求,旨在确保产品的安全性、质量和有效性。cGMP认证是指药企按照FDA的规定,通过审核和评估,证明其生产过程和质量管理系统符合cGMP要求的过程。获得cGMP认证可以增加产品在美国市场的竞争力,并提高消费者对产品质量和安全性的信任。进行美国cGMP认证,一般需要准备以下资料:...
-
中国GMP认证合规咨询-药品生产质量管理规范辅导培训
中国GMP认证是指药品生产质量管理规范的认证,旨在确保药品生产企业按照一定的质量管理要求进行生产,以保证药品的质量和安全。该认证包括质量管理体系、设备设施、原辅料管理、生产过程控制、质量控制、文档管理和不良品管理等方面的要求。1.在质量管理体系方面,药品生产企业需要建立完善的质量管理体系,包括质量方针、质量目标、质量手册等文件,并按照规定的要求进行运行和持续改进。2.在设备设施方面,药品生产企业需要确保生产设备和设施的合理选用、验证、维护和管理,以确保生产过程的质量和安全。3.在原辅料管...