FDA认证资讯 第35页
-
美国FDA澄清紧急授权指定医疗设备不良事件报告要求
2020年6月17日美国食品和药物管理局(US Food and Drug Administration)已经制定了不良事件报告期望值,该期望值符合根据该机构的紧急使用授权(EUA)计划可分发的医疗设备,以帮助应对COVID-19公共卫生危机。 FDA认证发布的新问答资源涵盖了具有EUA名称的设备的特定不良通风口报告要求,以及报告提交规则,时间表和相关规则与建议。由于冠状病毒大流行继续,许多EUA指定的设备(包括呼吸器,IVD测试套件...
-
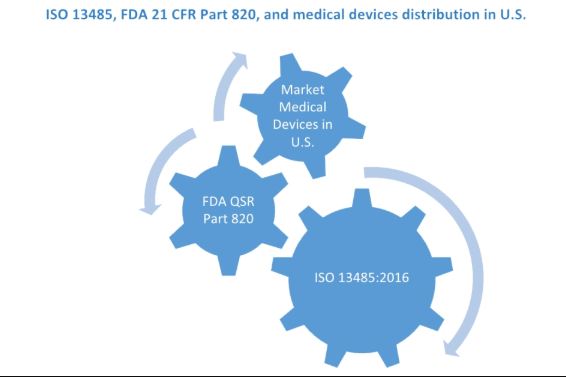
什么是FDA认证质量体系21 CFR Part 820法规?
什么是21 CFR Part 820法规? 美国的医疗器械制造商以及在美国分销其医疗器械的外国制造商都必须遵守GMP法规。制造商必须在组织中实施质量体系,以确保设备达到或超过质量要求,并且对于预期用途是安全有效的。在检查是否发现任何不符合项之后,FDA将根据21 cfr 820的要求进行现场检查,FDA将发布FDA 483表格并附有观察结果。GMP要求在21 CFR Part 820中进行了描述,与国际标准ISO 13485相似。与ISO 13485或CE标记不同,没有GMP...
-
FDA 21 CFR Part 820和ISO 13485之间的异同
ISO 13485:2016 是医疗器械制造商和供应商的质量管理体系的自愿性标准,在全球范围内用于开发和维护满足医疗器械市场需求的系统。修订ISO 13485的主要原因之一是使国际标准与自2003年以来不断发展的通用监管理念保持一致。ISO13485受到了世界领先的医疗器械监管机构的影响,例如FDA(食品和药品管理局)。 自2003年以来,医疗器械监管流程取得了长足进步。2016年,对ISO 13485的修订导致对产品安全...
-
FDA认证21 CFR PART 820:应避免的8个最常见错误
在 FDA法规和 监管合规与 不合格管理以及 FDA 21 CFR Part 820和 纠正措施预防措施(CAPA)和 设计历史记录文件(DHF)以及 医疗器械质量管理系统(MDQMS)中,如果您是一家医疗设备公司,或者打算在美国市场上销售产品,则应该熟悉FDA的21 CFR Part 820质量体系法规(QSR)。期望制造商遵循FDA的质量体系法规要求,以管理用于人类的医疗器械的设计,制造,包装,标签,存储,安装和维修。21 CFR Part 820中的要求旨在确保在美国...
-
FDA注册-乳胶和丁腈手套
丁腈手套FDA注册: FDA认证规范乳胶和丁腈手套(检查和手术用)作为医疗设备。即使手套是1类设备,它也需要FDA 510K许可,医疗设备机构注册以及在美国市场上列出的设备。出于医疗目的,粉状手套不允许在美国销售。FDA检查和手术手套分类:法规编号产品代码手套类型866.212JTM厌氧盒手套880.625OPI抗菌医用手套880.625QDO芬太尼和其他阿片类保护手套880.625YYYY乳胶病人检查手套880.625OPJ带有化学疗法标签要求的医用手套880.625FMC...
-
FDA认证 483警告信回复中的步骤
对FDA认证 483观察结果的响应: 如果FDA检查员发现任何不符合项(令人反感的条件或违规行为),则在完成FDA检查后将FDA 483发给公司管理层。您将有15天的时间来准备和提交回复信。在FDA检查员离开公司之前,请确保您了解这些观察结果,如果您有任何疑问或需要澄清,可以在闭门会议时与FDA检查员进行讨论。您对FDA 483信函的答复方式非常重要,FDA 483答复信函必须具有根本原因分析,纠正和预防措施计划以及纠正观察结果的时间表。FDA认证483警告信回复中的步骤:1...
-
FDA 483警告信详细介绍
FDA 483警告信是什么意思? 如果在检查后发现企业不符合GMP法规,则FDA会发出警告信。最好了解FDA认为不合规的常见情况。在大多数情况下,缺少适当的文档,记录或证据会导致发出警告信。此函由监管部门主管签字,EIR报告由审核官签字,最终纸质邮寄给该企业负责人。FDA检验意见下面的列表提供了FDA近年来向医疗器械机构发布的调查观察结果的示例。您可以在FDA 483数据库中搜索警告字母。测量和测试设备的校准日期记录不完整。未执行接受或拒绝收货产品的程序。投诉处理程序尚未执行...
-
FDA认证检查–FDA 483警告信
什么是FDA认证 483警告信? FDA检查生产,加工或包装受FDA管制的产品(如医疗器械,药品,化妆品,食品等)的企业。FDA会在短时间内进行随机检查,以验证是否符合GMP要求。FDA ORA(法规事务办公室)负责现场检查。 FDA医疗器械审核基于21 CFR 820法规。对于小型医疗设备机构,FDA可能会安排2-3天的检查时间,并选择3或4个区域或完整的质量管理体系进行检查。在检查是否发现任何不合格(不合规)之后,FDA将发布带有FD...
-
如何获得FDA认证批准?
如何获得FDA认证批准?“ FDA批准”是产品标签上常用的术语,尤其是在互联网站点上销售的产品。他们真的通过了FDA的批准吗?FDA仅在审查产品的安全性和有效性后才批准该产品。大多数产品不需要FDA批准就可以在美国上市,只需要FDA注册即可。此外,FDA不会批准生产企业,FDA可能会对GMP符合性进行审核/检查。成功进行FDA审核/检查而没有任何不合规行为并不意味着FDA批准了该企业。FDA食品认证FDA不批准食品或食品设施。食品工厂必须在FDA注册并列出产品类别。成功注册后,FDA将立即分配11位注册号。食品标签...
-
药品FDA认证机构注册续签
药品FDA认证注册续签办理: 在美国FDA注册的国内外药物企业必须每年10月1日至12月31日之间续签注册。续展必须以SPL格式提交,并具有通过FDA ESG在原始企业注册SPL中使用的相同ID。机构注册有效期至明年12月31日。续订后,FDA注册号或机构标识符将保持不变。 药品制造商必须在FDA至少拥有一份药品清单,以保持其机构注册和NDC标签代码有效。如果企业未在12月31日之前更新注册,则FDA可能会认为其药品品牌错误,并可能采取...
-
美国FDA认证更新了口罩和呼吸器的执法政策
向非NIOSH批准的一次性过滤式口罩呼吸器(FFR)的制造商发出了紧急使用授权(EUA)信件,该信件允许产品满足另一个国家/地区的要求,限于澳大利亚,巴西,欧洲,日本,韩国和墨西哥,将根据EUA投放市场。2020年4月3日,欧盟发布了另一个EUA,允许在一定条件下将未经NIOSH批准的中国制造的呼吸器投放市场。 遵循2020年4月修订的指南并扩大了EUA之后,FDA和疾病控制中心(CDC)开始收到投诉并对进入市场的呼吸器进行测试,发现...
-
FDA认证PMA重大缺陷增加,510(k)要求提供信息咨询
FDA认证关于设备提交和授权趋势的最新季度报告显示,在该机构的2020财年第二季度(即1月1日至3月31日),在第一个审查周期中向原始PMA申请人发严重缺陷信件的比率再次上升。寻求批准用于更复杂,更高风险设备的公司中,四分之三的公司在第一个周期受到重大缺陷通知的打击,较2019年的73%和2018年的63%有所上升2016年为91%。在第一个审阅周期中,收到额外信息请求的510(k)提交率与去年同期持平,为63%,比2018年下降了一个百分点。根据FDA数据库,在此期间授予...
-
美国FDA认证注册编号查询搜索
在美国FDA注册的制造商经常问:在哪里可以找到我的FDA注册号?如何在FDA网站上看到我的注册号?我的客户如何搜索我的FDA注册编号?我怎么知道FDA注册已经完成?FDA是否发送带有FDA注册号的注册证书? 每种注册类型的FDA要求都不同,对于食品工厂,制造商的FDA注册号是强制性的,注册完成后将立即获得注册号。但是对于药品和医疗设备机构而言,FDA注册编号不是强制性的,但机构必须完成注册。FDA可能需要90天或更长时间分配药物和医疗设备机构的注册号。在完成食品,药品,医疗设...
-
美国FDA认证代理_FDA注册续签服务-深圳商通检测
FDA注册: FDA注册是在美国境内生产或销售食品,药品,API或医疗设备的国内外机构的基本要求。FDA对化妆品企业的注册不是强制性的,但可以参加FDA自愿化妆品注册计划(VCRP)。美国FDA认证代理: 所有外国机构必须在注册过程中识别美国FDA代理。这是强制性要求,没有美国FDA代理;注册无法完成。Liberty Management Group Ltd为外国食品,药品,API和医疗设备机构提供美国FDA代理服务。FDA注册续签:&...
-
FDA认证在有效FCS通知清单中添加了18种新物质
美国食品药品监督管理局(FDA认证)最近在其有效食品接触物质(FCS)通知清单中添加了18种新物质。下面列出了新列出的物质和制造商。FCN编号食品接触物质制造商/供应商生效日期2045年2-丙酸,2-甲基-,与2-丙烯酸丁酯,2-甲基-2-甲基丙烯酸环己酯,2-甲基-2-丙烯酸甲酯,2-环氧乙烷基甲基2-甲基-2-丙烯酸酯,1,2-的聚合物丙二醇单(2-甲基-2-丙烯酸酯)和2-丙-1-基-2-甲基-2-丙烯酸酯(CAS登记号1874228-60-0)阿克苏诺贝尔涂料公司2020年4月28日2043年醋酸纤维素(C...